
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态Ni原子的价电子(外围电子)排布式为 ;
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 ;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③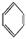 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”);
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下图所示。该合金的化学式为 ;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语。
下列有关化学用语的表示方法中正确的是( )
A.H2O2的电子式: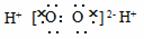
B.NH4I的电子式 : 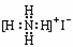
C.原子核内有8个中子的碳原子: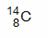
D.CO2分子的结构式:O=C=O
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7)。工艺流程及相关物质溶解度曲线如图
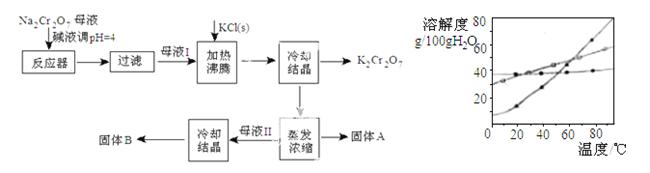 (1)由Na2Cr2O7生产K2Cr2O7的化学方程式为
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为  。通过冷过结晶析出大量K2Cr2O7的原因是 。
。通过冷过结晶析出大量K2Cr2O7的原因是 。
(2)向Na2Cr2O7母液中加碱液调pH的目的是 。
(3)固体A主要为 (填化学 式)
式) ,固体B主要为 (填化学式)。
,固体B主要为 (填化学式)。
(4)用热水洗涤固体A,回收的洗涤液转移到母液 (填“I”“II”或“III”)中,既能提高产率又可使能耗最低。
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V形分子,c的+1价离子比e的-1价离子少8个电子。
回答下列问题:
(1)元素a为________,c为________。
(2)由这些元素形成的双原子分子为________。
(3)由这些元素形成的三原子分子中,分子的空间结构属于直线形的是________,非直线形的是________(写2种)。
(4)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于原子晶体的是________,离子晶体的是________,金属晶体的是________,分子晶体的是________(每空填一种)。
(5)元素a和b形成的一种化合物与c和b形成的一种化合物发生的反应常用于防毒面具中,该反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
早期发 现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成
现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成 。回答下列问题:
。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: 可用硫氰化钾检验三价铁离子,形成配合物的颜色为
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化 亚铜,乙醛中碳原子的杂化轨道类型为 ______;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
亚铜,乙醛中碳原子的杂化轨道类型为 ______;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
(1)A原子核外比X原子多3个电子,A的原子结构示意图是____________,X的氧化物晶体中含有化学键类型是____________,含1 mol X的氧化物晶体中含有共价键数目为________。
(2)Z与钙离子组成的化合物的电子式为_________________,
其晶体类型为____________。
(3)14 g Y完全燃烧放出的热量是141.5 kJ,写出Y燃烧的热化学方程式______________________。
(4)组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(反应条件和其他物质已略)



①写出丁在高温下与水蒸气反应的化学方程式________________________。
②组成W的元素的简单氢化物极易溶于水的主要原因是
______________________,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH溶液,其负极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为________。
②NO 的空间构型是________(用文字描述)。
的空间构型是________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为________。
②H2O分子中O原子轨道的杂化类型为________。
③1 mol CO2中含有的σ键数目为________。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的铜与一定量的浓硝酸反应得到硝酸铜溶液和NO、N2O4、NO2 的混合气体,这些气体与1.68升O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则和铜反应的硝酸的物质的量可能是( )
A.0.4mol B.0.55mol C.0.6mol D.0.65mol
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.0.1mol丙烯酸中含有双键的数目为0.1NA
C.标准状况下,11.2L苯中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com