

| A、△H1=△H2=△H3=△H4 |
| B、△H1-△H2-△H3=△H4 |
| C、△H1-△H3=△H2-△H4 |
| D、△H1>△H2>△H3>△H4 |


科目:高中化学 来源: 题型:
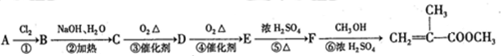 ,
,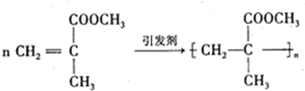
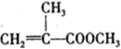 是有机玻璃的单体.下列物质属甲基丙烯酸甲酯同分异构体的是
是有机玻璃的单体.下列物质属甲基丙烯酸甲酯同分异构体的是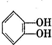 、④
、④
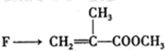
查看答案和解析>>
科目:高中化学 来源: 题型:
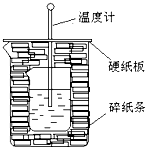 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验中所用到的锥形瓶和容量瓶,在洗涤后均需要润洗 |
| B、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,最终氢氧化钠溶液浓度将偏大 |
| C、滴定时,左手提酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视滴定管内液面变化 |
| D、中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.6 g |
| B、2.4 g |
| C、3.2 g |
| D、4.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 以铬酸钾((K2CrO4))为原料,用电化学法制备铬酸钾(K2CrO4)的实验装置如图,其反应原理可表示为4Kr2CrO4+4H2O
以铬酸钾((K2CrO4))为原料,用电化学法制备铬酸钾(K2CrO4)的实验装置如图,其反应原理可表示为4Kr2CrO4+4H2O| 通电 |
| A、在阴极室,随着反应的进行溶液的pH逐渐变小 |
| B、不锈钢电极上生成O2,惰性电极上得到H2 |
| C、惰性电极发生的电极反应为2H2O-4e-═4H++O2↑ |
| D、不锈钢应连接直流电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C02、CS2、SO2都是直线型的分子 |
| B、COCl2、SF6、CO32-都是平面三角型的分子 |
| C、BF3分子的键角大于CH4分子的键角 |
| D、PCl3、NH3、BCl3都是三角锥形的分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com