
【题目】Ⅰ. 在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)用D表示2 min内的平均反应速率为________,A的转化率为________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度________(填“增大”、“减
少”或“不变”)。
(3)若开始时只加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡相等,则还应加
入______ mol B物质。
(4)若向原平衡体系中再投入1 mol A和1 mol B,平衡________(填“右移”、“左移”或“不
移动”)。
Ⅱ.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则 :
①每消耗1 mol CH4可以向外电路提供____ mol e-;
②负极电极反应式为__________________________________________;
③电池放电后,溶液的pH不断________。
【答案】 0.2 mol·L-1·min-1 60% 增大 4/3 右移 8 CH4+10OH--8e-=CO![]() +7H2O 减小
+7H2O 减小
【解析】(Ⅰ)(1)V(D)=c/t=0.8mol÷2L÷2min=0.2 mol·L-1·min-1;
根据化学方程式:3A(g)+B(g) ![]() 2C(g)+2D(g)
2C(g)+2D(g)
初始物质的量(mol) 2 2 0 0
转化物质的量(mol)1.2 0.4 0.8 0.8
平衡物质的量(mol)0.8 1.6 0.8 0.8
则A的转化率=1.2mol÷2mol×100%=60%。
(2)反应混合物都为气体,总质量不变,体积减小,平衡体系中混合气体的密度增大。
(3)平衡时各物质的质量分数与原平衡相等,为等效平衡,应前后气体体积不变,按化学计量数转化到左边,满足n(A):n(B)=1:1即可。根据
3A(g)+B(g)![]() 2C(g)+2D(g)可知,C和D各4/3mol,转化到左边可得A为2mol,B为2/3mol。令B的物质的量为nmol,则:2mol:(n+2/3)mol=2mol:2mol,解得n=4/3。
2C(g)+2D(g)可知,C和D各4/3mol,转化到左边可得A为2mol,B为2/3mol。令B的物质的量为nmol,则:2mol:(n+2/3)mol=2mol:2mol,解得n=4/3。
(4)增大反应物的浓度,平衡向正反应方向移动。
(Ⅱ)(1)CH4完全燃烧生成二氧化碳,碳元素由-4价转化为+4价,则每消耗1 mol CH4可以向外电路提供8 mol e-;②生成的二氧化碳在碱性介质中生成碳酸酸离子,半反应为:CH4+10OH--8e-=CO![]() +7H2O;③电池放电后,由半反应可知溶液的pH不断下降。
+7H2O;③电池放电后,由半反应可知溶液的pH不断下降。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】航天飞船可用肼(N2H4)作动力源.已知1g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
A.肼(N2H4)分子中只存在极性共价键
B.该反应中肼作还原剂
C.该反应的反应物总能量高于生成物的总能量
D.此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.25mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )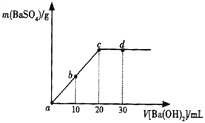
A. 硫酸溶液的体积为25 m L
B. b时刻溶液中SO![]() 的浓度约为0.125 mol·L-1
的浓度约为0.125 mol·L-1
C. d时刻溶液的pH为12
D. 溶液的导电能力:c<d<b<a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
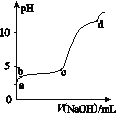
A. a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-![]() Al(OH)3
Al(OH)3
B. a~b段,溶液pH增大,Al3+浓度不变
C. b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D. d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业是国民经济的支柱产业。下列生产过程中不涉及化学变化的是( )
A. 氮肥厂用氢气和氮气合成氨 B. 钢铁厂用热还原法冶炼铁
C. 硫酸厂用接触法生产硫酸 D. 炼油厂用分馏法生产汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ/mol
CH3OH(g)+H2O(g) △H=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41 kJ/mol
CO(g)+H2O(g) △H=+41 kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图中状态Ⅰ(图中实线)所示。图中数据A(1,6)代表在1min时H2的物质的量是6mol。

①T℃时状态Ⅰ条件下,0~3min内CH3OH的平均反应速率v=_____________mol/(L·min),平衡常数K=____;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是_______;
③其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度________(填“>”“<”或“=”)T℃;
④若状态Ⅱ的平衡常数为K2,状态Ⅲ的平衡常数为K3,则K2____(填“>”“<”或“=”)K3;
⑤一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是_____。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实行垃圾分类,关系广大人民群众生活环境,关系节约使用资源,也是社会文明水平的一个重要体现。有害垃圾指对人体健康或者自然环境造成直接或者潜在危害的生活废弃物。下列不属于有害垃圾的是
A.过期药物B.废旧电池C.废杀虫剂D.金属易拉罐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 除去乙醇中微量水用金属钠 B. 溴苯中混有溴,加入水萃取
C. 用酸性高锰酸钾除去乙烷中的乙烯 D. 可用分液漏斗分离硝基苯和水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com