
ўе2SO2(g)+O2(g) ![]() 2SO3(g)·ҙУҰ№эіМөДДЬБҝұд»ҜИзНј
2SO3(g)·ҙУҰ№эіМөДДЬБҝұд»ҜИзНј ЛщКҫЎЈТСЦӘ1mol SO2(g)Сх»ҜОӘ1mol SO3өДҰӨH=-99kJЎӨmol-1.
ЛщКҫЎЈТСЦӘ1mol SO2(g)Сх»ҜОӘ1mol SO3өДҰӨH=-99kJЎӨmol-1.
Зл»ШҙрПВБРОКМвЈә
ўЕНјЦРAЎўC·ЦұрұнКҫ Ўў Ј¬EөДҙуРЎ¶ФёГ·ҙУҰөД·ҙУҰИИУРОЮУ°ПмЈҝ ЎЈёГ·ҙУҰНЁіЈУГV2O5ЧчҙЯ»ҜјБЈ¬јУV2O5»бК№НјЦРBөгЙэёЯ»№КЗҪөөНЈҝ Ј¬АнУЙКЗ Ј»
ўЖНјЦРЎчH= KJЎӨmol-1Ј»
ўЗТСЦӘөҘЦКБтөДИјЙХИИОӘ296 KJЎӨmol-1Ј¬јЖЛгУЙS(s)ЙъіЙ3 molSO3(g)өДЎчHЈЁТӘЗуРҙіцјЖЛг№эіМЈ©ЎЈ
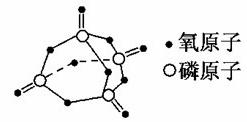 ўжҪшТ»ІҪСРҫҝұнГчЈ¬»ҜС§·ҙУҰөДДЬБҝұд»Ҝ(ҰӨH)Ул·ҙУҰОпәНЙъіЙОпөДјьДЬУР№ШЎЈјьДЬҝЙТФјтөҘөШАнҪвОӘ¶ПҝӘ1 mol»ҜС§јьЛщРиОьКХөДДЬБҝЈ¬ұнЦРКЗІҝ·Ц»ҜС§јьөДјьДЬКэҫЭЈә
ўжҪшТ»ІҪСРҫҝұнГчЈ¬»ҜС§·ҙУҰөДДЬБҝұд»Ҝ(ҰӨH)Ул·ҙУҰОпәНЙъіЙОпөДјьДЬУР№ШЎЈјьДЬҝЙТФјтөҘөШАнҪвОӘ¶ПҝӘ1 mol»ҜС§јьЛщРиОьКХөДДЬБҝЈ¬ұнЦРКЗІҝ·Ц»ҜС§јьөДјьДЬКэҫЭЈә
| »ҜС§јь | PЎӘP | PЎӘO | O==O | P==O |
| јьДЬ/kJЎӨmolЈӯ1 | 197 | 360 | 499 | x |
ТСЦӘ°ЧБЧөДИјЙХИИОӘ2378.0 kJ/molЈ¬°ЧБЧНкИ«ИјЙХөДІъОпҪб№№ИзНјўуЛщКҫЈ¬ФтЙПұнЦРxЈҪ________ЎЈ
ЈЁ1Ј©·ҙУҰОпДЬБҝ ЈЁ1·ЦЈ© ЙъіЙОпДЬБҝ ЈЁ1·ЦЈ© ОЮ ЈЁ1·ЦЈ© ҪөөН ЈЁ1·ЦЈ©ТтОӘҙЯ»ҜјБёДұдБЛ·ҙУҰөДАъіМК№»о»ҜДЬEҪөөН ЈЁ1·ЦЈ©
ЈЁ2Ј©-198 ЈЁ2·ЦЈ©
ЈЁ3Ј© S(s)+O2(g) =2SO2(g)ЎчH1=-296 KJЎӨmol-1 , SO2(g)+1/2O2(g) ![]() SO3(g) ЎчH2=-99 KJЎӨmol-1
SO3(g) ЎчH2=-99 KJЎӨmol-1
3 S(s)+9/2O2(g)=3SO3(g) ЎчH=3(ЎчH1+ЎчH2)=-1185 KJЎӨmol-1 ЈЁ3·ЦЈ©
433.75ЈЁ3·ЦЈ©



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2011-2012С§ДкХгҪӯБЩәЈКР°ЧФЖёЯј¶ЦРС§ёЯ¶юПВС§ЖЪЖЪЦРҝјКФ»ҜС§ҫнЈЁҙшҪвОцЈ© МвРНЈәМоҝХМв
ЈЁГҝҝХ3·ЦЈ¬№І9·ЦЈ©ЗлРҙіцПВБР·ҙУҰөДИИ»ҜС§·ҪіМКҪЈә
ЈЁ1Ј©25ЎжКұЈ¬1 gјЧНйЖшМеНкИ«ИјЙХЙъіЙ¶юСх»ҜМјЖшМеәНТәМ¬Л®Ј¬·Еіц55.64kJИИБҝЈ¬РҙіцёГ·ҙУҰөДИИ»ҜС§·ҪіМКҪЈә ЎЈ
ЈЁ2Ј©ТСЦӘ¶ПБС1 mol H2(g)ЦРөДHЎӘHјьРиТӘОьКХ436kJөДДЬБҝЈ¬¶ПБС1 mol O2(g)ЦРөД№ІјЫјьРиТӘОьКХ498kJөДДЬБҝЈ¬ЙъіЙH2O(g)ЦРөД1mol HЎӘOјьДЬ·Еіц463kJөДДЬБҝЎЈКФРҙіцO2(g)УлH2(g)·ҙУҰЙъіЙH2O(g)өДИИ»ҜС§·ҪіМКҪЈә ЎЈ
ЈЁ3Ј©ТСЦӘЈә2H2S(g)Ј«O2(g)ЈҪ2S(s)Ј«2H2O(l) ЎчHЈҪЈӯa kJЎӨmolЈӯ1Ј»
2H2S(g)Ј«3O2(g)ЈҪ2SO2(g)Ј«2H2O(l) ЎчHЈҪЈӯb kJЎӨmolЈӯ1ЎЈ
ФтH2SУлSO2БҪЦЦЖшМеЧӘ»ҜОӘ№ММеБтөДИИ»ҜС§·ҪіМКҪОӘ ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2014ҪмЙҪОчКЎёЯ¶ю8ФВФВҝј»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәСЎФсМв
ФЪИЭЖчЦРідИлSO2әНЦ»УЙ18OФӯЧУЧйіЙөДСхЖш18O 2Ј¬ФЪТ»¶ЁМхјюПВ·ҙУҰЈә
2SO2(g)
Ј«O 2(g) 2SO3(g)Ј¬ҙпөҪЖҪәвКұЈ¬ 18OҙжФЪУЪЈЁ Ј©
2SO3(g)Ј¬ҙпөҪЖҪәвКұЈ¬ 18OҙжФЪУЪЈЁ Ј©
A. Ц»ҙжФЪУЪO 2ЦР
B. Ц»ҙжФЪУЪO 2әНSO3ЦР
C. Ц»ҙжФЪУЪSO2әНSO3ЦР
D. SO3ЎўSO2әНO 2ЦР¶јУРҝЙДЬҙжФЪ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2010-2011С§Дкұұҫ©ГЕН·№өЗшёЯИэДкј¶ійСщІвКФАнҝЖЧЫәПДЬБҰІвКФ»ҜС§Іҝ·Ц МвРНЈәСЎФсМв
ИфСхФӘЛШЦ»УР16OЎў18OБҪЦЦәЛЛШЈ¬ПВБРЛө·ЁХэИ·өДКЗ
AЈ®16O2Ул18O2»ҘОӘН¬О»ЛШ
BЈ®Пт2SO2(g)
+ O2(g)  2SO3(g) өДЖҪәвМеПөЦРјУИл18O2Ј¬ҙпөҪРВөДЖҪәвәу18O2Ц»іцПЦФЪO2УлSO3ЦР
2SO3(g) өДЖҪәвМеПөЦРјУИл18O2Ј¬ҙпөҪРВөДЖҪәвәу18O2Ц»іцПЦФЪO2УлSO3ЦР
CЈ®CH3COOHәНCH3CH218OH·ўЙъхҘ»Ҝ·ҙУҰКұЈ¬ІъОпЦР·ЦЧУКҪОӘH218O
DЈ®УГ¶иРФөзј«өзҪвә¬УРH218OөДЖХНЁЛ®КұЈ¬Сфј«ҝЙДЬІъЙъИэЦЦПа¶Ф·ЦЧУЦКБҝІ»Н¬өДСх·ЦЧУ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2013ҪмәЪБъҪӯКЎёЯТ»ПВС§ЖЪЖЪЦРҝјКФ»ҜС§КФҫн МвРНЈәСЎФсМв
ИфСхФӘЛШЦ»УР16OЎў18OБҪЦЦәЛЛШЈ¬ПВБРЛө·ЁХэИ·өДКЗ
AЈ®16O2Ул18O2»ҘОӘН¬О»ЛШ
BЈ®УГКҜД«өзј«өзҪвә¬УРТ»¶ЁБҝH218OөДЖХНЁЛ®КұЈ¬Сфј«ҝЙДЬІъЙъИэЦЦПа¶Ф·ЦЧУЦКБҝІ»Н¬өДСх·ЦЧУ
CЈ®20g H218OЦРә¬УР12molЦКЧУ
DЈ®SO3ЦРөДИэёцS-OјьКЗөИН¬өДЈ¬Пт 2SO2(g)
+ O2(g)  2SO3(g) өДЖҪәвМеПөЦРјУИл18O2Ј¬ҙпөҪРВөДЖҪәвәу18O2Ц»іцПЦФЪO2УлSO3ЦР
2SO3(g) өДЖҪәвМеПөЦРјУИл18O2Ј¬ҙпөҪРВөДЖҪәвәу18O2Ц»іцПЦФЪO2УлSO3ЦР
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ТСЦӘИИ»ҜС§·ҪіМКҪЈә2SO2(g)+ O 2(g) ![]() 2SO3(g) ЎчH= - 196.64kJ/mol Ј¬ФЪИЭЖчЦРідИЛ2molSO2 әН1molO2 ід·Ц·ҙУҰЈ¬ЧоЦХ·ЕіцөДИИБҝОӘ ( )
2SO3(g) ЎчH= - 196.64kJ/mol Ј¬ФЪИЭЖчЦРідИЛ2molSO2 әН1molO2 ід·Ц·ҙУҰЈ¬ЧоЦХ·ЕіцөДИИБҝОӘ ( )
AЈ®196.64kJ BЈ®196.64 kJЎӨmol CЈ®<196.64kJ DЈ®>196.64kJ
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com