
【题目】(1)5.4 g H2O的物质的量是_____,含有_________个水分子(用NA表示),含有____mol H。
(2)11.2L NH3(标况)约含_____ mol氢原子,_____ g的氮原子。
(3)6.02×1022个OH 的质量为____,含有质子的物质的量为_____,含有电子的物质的量为__ 。
(4)12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为_______,R的相对原子质量为_______。含R的质量为1.6 g的Na2R,其物质的量为________。
(5)物质的量相同的CO2和O2,其所含原子数目之比为_____,所含氧原子数目之比为______;质量相同的CO2和O2,其物质的量之比为_________。
【答案】0.3mol 0.3NA 0.6 1.5 7 1.7g 0.9mol 1mol 62g/mol 16 0.1mol 3:2 1:1 8:11
【解析】
(1)~(4)根据n=![]() 、N=nNA、n=
、N=nNA、n=![]() 、进行计算;
、进行计算;
(5)根据阿伏加德罗定律进行计算。
(1)5.4 g H2O的物质的量n=![]() =
=![]() =0.3mol;水分子的个数=nNA=0.3NA;氢原子的物质的量为0.3mol×2=0.6mol;
=0.3mol;水分子的个数=nNA=0.3NA;氢原子的物质的量为0.3mol×2=0.6mol;
(2)NH3的物质的量n=![]() =
=![]() =0.5mol,氢原子的物质的量为0.5mol×3=1.5mol,氮原子的物质的量为0.5mol,质量m=nM=0.5mol×14g/mol=7g;
=0.5mol,氢原子的物质的量为0.5mol×3=1.5mol,氮原子的物质的量为0.5mol,质量m=nM=0.5mol×14g/mol=7g;
(3)OH 的物质的量n=![]() =
=![]() =0.1mol,质量m=nM=0.1mol×17g/mol=1.7g;1molOH-含有9mol质子,0.1molOH-含有0.9mol质子;1molOH-含有10mol电子,0.1molOH-含有1mol电子;
=0.1mol,质量m=nM=0.1mol×17g/mol=1.7g;1molOH-含有9mol质子,0.1molOH-含有0.9mol质子;1molOH-含有10mol电子,0.1molOH-含有1mol电子;
(4)Na2R含Na+0.4 mol,则Na2R的物质的量为0.2mol,其摩尔质量M=![]() =
=![]() =62g/mol;R的相对原子质量=62-2×23=16;R的物质的量=
=62g/mol;R的相对原子质量=62-2×23=16;R的物质的量=![]() =0.1mol,那么Na2R物质的量为0.1mol;
=0.1mol,那么Na2R物质的量为0.1mol;
(5)1molCO2含有3mol原子,1molO2含有2mol原子,所含原子数目之比为3:2;1molCO2含有2mol氧原子,1molO2含有2mol原子,所含氧原子数目之比为1:1;物质的量之比![]() =
=![]() =
=![]() =
=![]() =
=![]() 。
。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】功能高分子P的合成路线如下:

(1)A的分子式是C7H8,其结构简式是___________________。
(2)试剂a是_______________。
(3)反应③的化学方程式:_______________。
(4)E的分子式是C6H10O2。E中含有的官能团:_______________。
(5)反应④的反应类型是_______________。
(6)反应⑤的化学方程式:_______________。
(5)已知:2CH3CHO 。
。
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制银氨溶液操作如图所示,下列说法错误的是( )
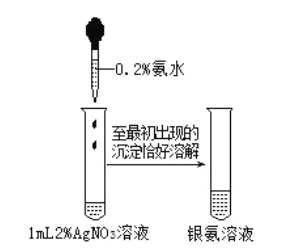
已知:![]() ,
,
A.制得的银氨溶液可用于还原性糖的检验
B.![]() 中含有
中含有![]() 个
个![]() 键
键
C.银氨溶液不能长期存放,需要现用现配
D.![]() 固体可溶于氨水得到银氨溶液
固体可溶于氨水得到银氨溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度为1.5 mol·L-1
B. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
C. 把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
D. 把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)元素金(Au)处于周期表中的第6周期,与Cu同族,金原子最外层电子排布式为_________;一种铜合金晶体具有立方最密堆积的结构,在晶胞中铜原子处于面心,金原子处于顶点位置,则该合金中铜原子与金原子数量之比为_____,该晶体中,原子之间的作用力是________;
(2)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为_____________。

(3)CuSO4晶体的构成微粒是____和____,微粒间的作用力是_______,该晶体属于____晶体;
(4)SO42-中S以sp3杂化,SO42-的立体构型是__________________________;
(5)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除大气中的NOx,保护臭氧层,是环境保护的重要课题。
(1)在没有NOx催化时,O3的分解可分为以下两步反应进行;
①O3=O+O2 (慢) ②O+O3=2O2 (快)
第一步的速率方程为v1=k1c(O3),第二步的速率方程为v2=k2c(O3)·c(O)。其中O为活性氧原子,它在第一步慢反应中生成,然后又很快的在第二步反应中消耗,因此,我们可以认为活性氧原子变化的速率为零。请用k1、k2组成的代数式表示c(O)=____________。
(2)NO做催化剂可以加速臭氧反应,其反应过程如图所示:
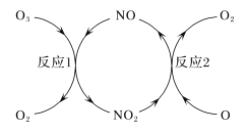
已知:O3(g)+O(g)=2O2(g) ΔH=-143 kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ/mol。
反应2:热化学方程式为____________________________。
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变![]() ,NOx的去除率如图所示。
,NOx的去除率如图所示。
已知:NO与Ca(OH)2不反应;
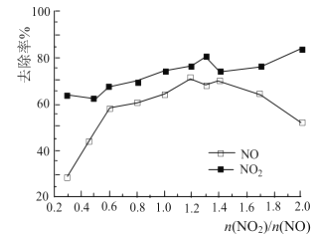
NOx的去除率=1-![]() ×100%
×100%
①![]() 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
②当![]() 大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8 kJ/mol,反应达到平衡时,N2的体积分数随![]() 的变化曲线如图。
的变化曲线如图。
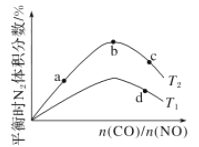
①b点时,平衡体系中C、N原子个数之比接近________。
②a、b、c三点CO的转化率从小到大的顺序为________;b、c、d三点的平衡常数从大到小的顺序为__________(以上两空均用a、b、c、d表示)。
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锰在冶金工业中用来制造特种钢,常作为脱硫剂和去氧剂,其化合物广泛应用于电池、机械制造业等领域。
(1)以软锰矿(主要为MnO2)为原料通过热还原法得到金属锰涉及的两个反应:
①3MnO2(s)=Mn3O4(s)+ O2(g) △H1= akJmol-1
②3Mn3O4(s)+ 8Al(s) =4Al2O3(s) + 9Mn(s) △H2= bkJmol-1
已知Al的燃烧热为 △H3=ckJmol-1,则MnO2与Al发生铝热反应的热化学方程式为___________。
(2)科研人员将制得的锰粉碎后加入到SnCl2溶液中使其浸出(假定杂质不反应,溶液 体积不变),发生反应Mn(s)+ Sn2+(aq)![]() Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
请回答下列问题:
①为加快反应速率可以采取的措施有__________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是____________________。
②下列能说明反应已达平衡的有____________________(填编号)。
A.溶液的颜色不发生变化 B.溶液中c(Mn2+)=c( Sn2+)
C.体系中固体的质量不变 D.Mn2+与Sn2+浓度的比值保持不变
③室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=________________,Mn2+的产率为____________。
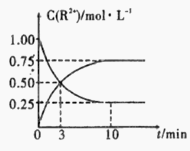
④若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则 再次平衡时c(Mn2+) =____________(不考虑离子水解的影响)。
(3)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为_____________________,阳极附近溶液的pH____________(选填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学中常用的物理量,请完成以下有关内容。
(1)咖啡含有咖啡因(化学式为C8H10N4O2),则咖啡因的摩尔质量为__________g/mol。
(2)0.2 g H2大约含有________个H原子。
(3)100 mL某Al2(SO4)3溶液中,c(Al3+)=2.0 mol/L,其中c(SO42-)= ________mol/L。
(4)8 克O2和O3的混合气体中氧原子的物质的量为 ________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com