
分析 (1)根据n=$\frac{m}{M}$计算分子中C、H原子数目之比,进而确定实验式;
(2)根据M=ρVm确定该烃摩尔质量,结合实验式确定分子式;
(3)经红外光谱测定该烃分子中含一个双键,结合分子式书写可能的结构简式,再进行命名.
解答 解:(1)气态烃含C 85.7%,含H 14.3%,则分子中N(C):N(H)=$\frac{85.7%}{12}$:$\frac{14.3%}{1}$=1:2,则该气态烃的实验式为CH2,
故答案为:CH2;
(2)气态烃在标准状况下的密度是2.5g/L,则其摩尔质量=2.5g/L×22.4L/mol=56g/mol,设分子式为(CH2)x,则14x=56,解得x=4,故该烃的分子式为C4H8,
故答案为:C4H8;
(3)经红外光谱测定该烃分子中含一个双键,可能的结构简式及名称为:CH2=CHCH2CH3,名称为1-丁烯,CH3CH=CHCH3,名称为2-丁烯,CH2=C(CH3)2,名称为2-甲基-1-丙烯,
故答案为:CH2=CHCH2CH3,1-丁烯; CH2=C(CH3)2,2-甲基-1-丙烯.
点评 本题考查有机物分子式的确定、同分异构体的书写,题目难度不大,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| B. | 稀氨水中加入氢氧化化钠固体少量,由于氨水的电离平衡逆向移动,所以溶液的碱性减弱 | |
| C. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}COO)}$ 的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
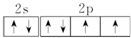 ,该元素的名称是氧;
,该元素的名称是氧;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于1.8mol | B. | 等于0.9mol | C. | 等于1.8mol | D. | 大于1.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2为0.4 mol/L | B. | SO2为0.3 mol/L、SO3为0.3 mol/L | ||
| C. | SO2为0.25 mol/L | D. | O2为0.05 mol/L、SO3为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出,两份蛋白质均发生变性 | |
| B. | 只用溴水就可以将苯、四氯化碳、酒精、己烯、苯酚这五种物质区别开来 | |
| C. | 由于纤维素易发生水解反应,所以用纤维素织成的衣物不可在碱性溶液中洗涤 | |
| D. | 丙氨酸 分子中含有1个手性碳原子 分子中含有1个手性碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com