
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
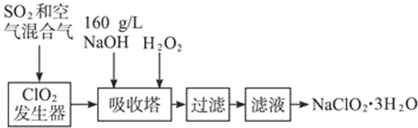
查看答案和解析>>
科目:高中化学 来源: 题型:
| v2o5 |
| △ |
| A、催化剂V2O5不改变该反应的逆反应速率 | ||
| B、增大反应体系的压强,反应速率一定增大 | ||
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 | ||
D、在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率v=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、比较等体积、等pH值的两种溶液的导电性 |
| B、比较等物质的量浓度的氯化钠与醋酸钠溶液的pH值 |
| C、比较等体积、等pH值的两种溶液与过量锌粉反应产生氢气的量 |
| D、比较等体积、等物质的量浓度的两种溶液稀释相同倍数后的pH变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、形成原电池后,原电池中的阳离子向正极移动 |
| B、原电池中电子流出的一极是正极,发生氧化反应 |
| C、原电池的两极发生的反应均为氧化还原反应 |
| D、原电池是把电能转化为化学能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com