
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、等pH的溶液物质的量浓度关系:C(NaCN)>C(Na2CO3)>C(CH3COONa) |
| B、amol/L HCN与b mol/LNaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b |
| C、相同体积相同浓度的NaCN 和CH3COONa溶液中,NaCN溶液的离子总数少 |
| D、HCN+CO32-→CN-+H2O+CO2↑ |


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:

 +CH3COOH→
+CH3COOH→ 聚合物
聚合物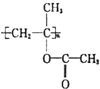 可用于制备高吸水性树脂,其单体的结构简式为
可用于制备高吸水性树脂,其单体的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生在A、B、C、D四只小烧瓶中分别放入:干燥的细铁丝;浸过食盐水的细铁丝;浸过清水的细铁丝.然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如表(表中所列数据为导管中水面上升的高度/cm)
某学生在A、B、C、D四只小烧瓶中分别放入:干燥的细铁丝;浸过食盐水的细铁丝;浸过清水的细铁丝.然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如表(表中所列数据为导管中水面上升的高度/cm)| 时间/波动 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| A瓶(盛干燥铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| B瓶(盛沾了食盐水的铁丝) | 0 | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 |
| C瓶(盛沾了清水的铁丝) | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离的c(H+):①=②=③=④ |
| B、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| C、将②、③溶液混合后,pH=7,消耗溶液的体积:②>③ |
| D、向溶液中加入100mL水后,溶液的pH:③>④>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| CH4 | C3H6 | C5H8 | C2H6 | C4H8 | C3H8 | C5H10 | C7H12 |
| A、1、4、7对应的烃互为同系物,2、5、8对应的烃互为同系物 |
| B、第6种烃与等物质的量的溴加成,所得产物有2种,则该烃的结构有4种(不考虑顺反异构) |
| C、第8种烃一定能使酸性高锰酸钾溶液褪色 |
| D、1、4、7对应的烃中碳的质量分数逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 440℃ |
| A、金刚石与石墨互为同素异形体 |
| B、11.5 g金属钠的物质的量为0.5 mol |
| C、44 g CO2在标准状况下的体积为22.4 L |
| D、Na2CO3的摩尔质量为106 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com