
| A. | 4、3、5 | B. | 4、3、6 | C. | 2、5、4 | D. | 4、6、4 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | 2,4-二甲基丁烷 | B. | 2,3,3-三甲基丁烷 | ||
| C. | 2-乙基-1-戊烯 | D. | 2,2,3-三甲基-1-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
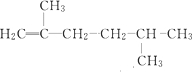 ;
;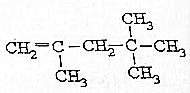
 ;
; →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
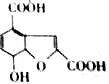
| A. | M的分子式为C18H8O8 | |
| B. | 1molM最多可与3molNa反应 | |
| C. | 一个M分子中含有一个苯环和两个羧基 | |
| D. | M可发生酯化反应,氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “三聚氰胺”奶粉事件是化学问题,不是商家的道德问题 | |
| B. | 爆炸一定是化学变化 | |
| C. | 某国产化妆品的生产不使用任何化学原理和方法 | |
| D. | 我们学习化学学科,应该做到:准确理解、辩证看待以及正面传播它 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 | |
| D. | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
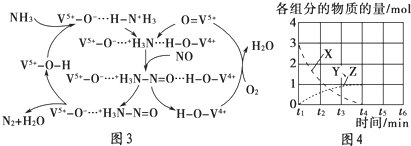
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 现象 |
| Ⅰ | 向2 mL 0.1 mol/LFeCl2溶液中滴加KSCN溶液,再滴加氯水 | |
| Ⅱ | 向2 mL 0.1 mol/L FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol/L KI溶液 | 滴加KSCN溶液后,溶液变成红色; 滴加KI溶液后,红色无明显变化 |
| 编号 | 操作 | 现象 |
| Ⅲ | 向2 mL 0.1 mol/L KI溶液中滴加1 mL 0.1 mol/L FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色; 滴加KSCN溶液后,溶液变成红色 |
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2 mL 0.1 mol/L KI溶液中滴加 1 mL 0.1mol/L FeCl3溶液,或CCl4;或铁氰化钾溶液 | 溶液变蓝(或溶液分层,下层溶液为紫色;或生成蓝色沉淀),结论:Fe3+能与I-发生氧化还原反应,生成I2(或Fe2+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com