
| A、常温、常压下,16 g O3中含有的氧原子数为NA |
| B、7.8 g Na2O2与水充分反应,转移的电子数为0.2 NA |
| C、0.1 mol Fe与0.1 mol Cl2充分反应,转移的电子数为0.3NA |
| D、标准状况下,11.2 L H2O中含有的氢原子数为NA |
| 16g |
| 48g/mol |


科目:高中化学 来源: 题型:
| A、①②③④ | B、①②③⑤ |
| C、①②④⑥ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液、胶体和浊液的本质区别在于分散质粒子的直径不同 |
| B、金属氧化物都属于碱性氧化物 |
| C、非金属氧化物都属于酸性氧化物 |
| D、氧化还原反应的本质是化合价发生升降 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的N2和CO所含有的原子数均为2NA |
| B、通常状况下,64g SO2中含有的分子数为NA |
| C、标准状况下,22.4L CH4和O2的混合气体所含有的分子数为2NA |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.72L NO2与水充分反应转移的电子数目为0.2NA |
| B、12.0g NaHSO4固体中含有的阳离子数为0.2NA |
| C、用含0.01 mol KI的稀溶液制取碘化银胶体时,产生胶体粒子0.01NA个 |
| D、常温下体积相同容器分别装有质量相同的N2、CO气体,产生的压强相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L |
| B、从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L |
| C、配制500 mL 0.2 mol/L的CuSO4溶液,需称量CuSO4固体的质量为16.0g |
| D、中和100 mL 1 mol/L的H2SO4溶液,需NaOH的质量为4.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液、胶体和悬浊液这三种分散系的本质区别是能否透过滤纸或半透膜 |
| B、仅用新制的氢氧化铜悬浊液一种试剂可鉴别乙醇、甘油、乙醛、乙酸、乙酸乙酯、葡萄糖溶液(必要时可加热) |
C、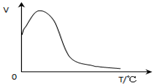 过氧化氢在酶催化作用下的分解反应速率随温度的变化关系如图所示 |
| D、工业上从海带中提取碘单质,经历的步骤有浸泡-过滤-氧化-结晶-粗碘提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.3 | 3.3 | 7.5 | 10.3 |
| 完全沉淀 | 2.8 | 5.2 | 9.7 | 12.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com