
| A. | Al3+、Cl-、Ca2+ | B. | Mg2+、SO42-、OH- | C. | Na+、SO32-、H+ | D. | H+、K+、OH- |
科目:高中化学 来源: 题型:解答题
 下表为某市售盐酸试剂瓶标签上的部分信息:
下表为某市售盐酸试剂瓶标签上的部分信息:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象及相关结论 |
| ①取少量电解质溶液于试管中,用pH试纸测其pH. | →试纸呈深蓝色,经比对溶液的pH约为14,说明溶液中有残余的KOH. |
| ②继续加入足量1mol•L-1HCl 溶液,再加入少量0.1mol•L-1BaCl2溶液,振荡. | →若有白色沉淀产生,则溶液中含有K2SO4. →若无白色沉淀产生,则溶液中没有K2SO4. |
| ③另取少量电解质溶液于试管中,先加1mol•L-1的H2SO4酸化,再滴入2~3滴0.01mol•L-1KMnO4酸性溶液,振荡. | →若KMnO4溶液紫红色褪去,则说明溶液中含有K2SO3,若KMnO4溶液紫红色不褪,则说明溶液不含K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

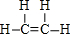 ;B的结构简式:CH3CH3;
;B的结构简式:CH3CH3;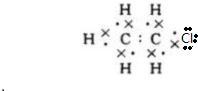 ;D的官能团名称羟基;G官能团的结构简式-COOH.
;D的官能团名称羟基;G官能团的结构简式-COOH.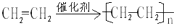 (反应类型加聚反应).
(反应类型加聚反应).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
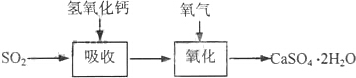
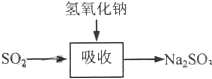
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗2n molSO2的同时生成2n molS03,说明该反应达到平衡状态 | |
| B. | 达到化学平衡时,SO2、02和SO3的物质的量浓度均保持不变 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,SO2将完全转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 瓶中气体的黄绿色逐渐变浅,内壁有油状液滴形成 | |
| B. | 若日光直射可能发生爆炸 | |
| C. | 甲烷与氯气发生了取代反应 | |
| D. | 生成物只有 CH3Cl、CH2Cl2、CHCl3、CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
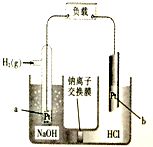
| A. | b极是负极 | |
| B. | a极电极反应式为H2-2e-═2H+ | |
| C. | 负载通过1mol电子,右池产生标况下5.6L气体 | |
| D. | 电池总反应式为:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com