


科目:高中化学 来源:不详 题型:多选题
| A.NaOH溶液与Al2(SO4)3溶液 |
| B.FeCl3溶液与CuSO4溶液 |
| C.NaHCO3溶液与HCl溶液 |
| D.CuO与Fe3O4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
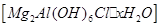 是一种新型离子交换材料,其在高温下完全分解为
是一种新型离子交换材料,其在高温下完全分解为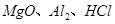 和水蒸气,现用题27图装置进行试验确定其化学式(固定装置略去)。
和水蒸气,现用题27图装置进行试验确定其化学式(固定装置略去)。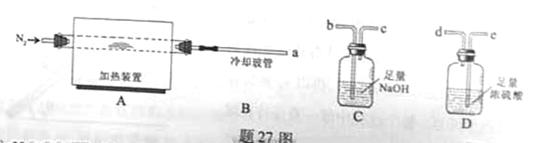
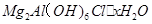 热分解的化学方程式为 。
热分解的化学方程式为 。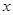 ,则装置的连接顺序为 (按气流方向,用接口字母表示),其中C的作用是 。装置连接后,首先要进行的操作名称是 。
,则装置的连接顺序为 (按气流方向,用接口字母表示),其中C的作用是 。装置连接后,首先要进行的操作名称是 。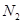 排尽装置中的空气,称取C、D的初始质量后,再持续通入
排尽装置中的空气,称取C、D的初始质量后,再持续通入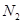 的作用是 、 等.
的作用是 、 等.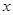 = .若取消冷却玻管B后进行试验,测定
= .若取消冷却玻管B后进行试验,测定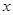 值将 (填“偏高”或“偏低”)
值将 (填“偏高”或“偏低”)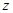 ,除测定D的增重外,至少还需测定 .
,除测定D的增重外,至少还需测定 .查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.0.5 mol·L-1氯化亚铁溶液 | B.0.5 mol·L-1氯化铜溶液 |
| C.0.5 mol·L-1盐酸 | D.0.5 mol·L-1氯化亚铁和0.5 mol·L-1氯化铜混合溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
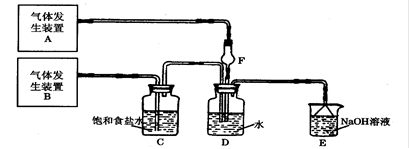
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
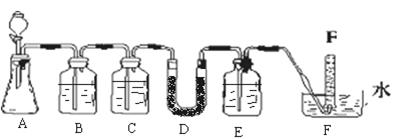
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | | 除去CO2中的水蒸气 |
| E | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
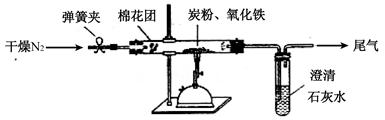
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
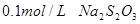 溶液、
溶液、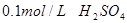 、烧杯、冷水、热水、秒表等
、烧杯、冷水、热水、秒表等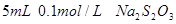 。
。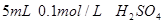 。
。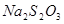 和
和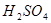 反应的化学方程式为 。
反应的化学方程式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
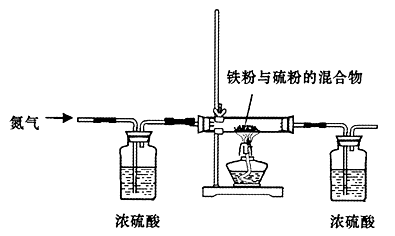
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com