
 A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )| A. | 若X为KOH溶液,则A可能为Al | |
| B. | 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2 | |
| C. | 若X为O2,则A可为非金属单质硫 | |
| D. | 若X为Fe,则C可能为Fe(NO3)2溶液 |
分析 根据图知,A+X→C,A$\stackrel{X}{→}$B$\stackrel{X}{→}$C,由此看出,A与X反应生成B还是C与X的量有关,
A.若X为KOH溶液,A为A1时和碱反应只能生成偏氯酸钾;
B.若A、B、C均为焰反应呈黄色的化合物,说明含钠元素,转化关系中A可以是NaOH,X可以是二氧化碳或二氧化硫,B为碳酸钠或亚硫酸钠,C为碳酸氢钠或亚硫酸氢钠;
C.若X为O2,A为非金属单质硫,则B为二氧化硫,C为三氧化硫,硫和氧气反应不能直接生三氧化硫;
D.若X为Fe,则A可以为HNO3,B为Fe(NO3)3溶液,C可能为Fe(NO3)2溶液;
解答 解:A.若X为KOH溶液,A为A1时和碱反应只能生成偏氯酸钾,偏铝钾不能和铝反应,不符合转化关系,A可以为Al3+,故A错误;
B.若A、B、C均为焰反应呈黄色的化合物,说明含钠元素,转化关系中A可以是NaOH,X可以是二氧化碳或二氧化硫,B为碳酸钠或亚硫酸钠,C为碳酸氢钠或亚硫酸氢钠,故B错误;
C.若X为O2,A为非金属单质硫时,可以实现A→B→C的转化,但不能实现A→C的转化,故C错误;
D.若X为Fe,则A和铁反应,铁的量不同产物不同,且产物可以和铁反应,证明A为氧化性酸,判断A可以为HNO3,B为Fe(NO3)3溶液,则C可能为Fe(NO3)2溶液,铁与硝酸反应生成硝酸铁,硝酸铁与铁反应生成硝酸亚铁,过量的铁与硝酸也可直接生成硝酸亚铁,故D正确;
故选D.
点评 本题考查了元素化合物性质与转化,注意掌握中学常见连续反应,熟练掌握元素化合物的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 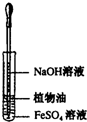 观察Fe(OH)2的生成 | B. | 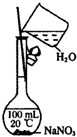 配制一定量浓度的NaNO3的溶液 | ||
| C. | 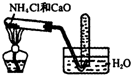 实验室制取氨气 | D. | 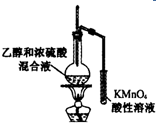 验证乙烯的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅能与水反应 | |
| B. | 用二氧化硅制取单质硅,当生成2.24 L(标准状况下)气体时,得到2.8g硅 | |
| C. | 二氧化硅属于传统的无机非金属材料 | |
| D. | 二氧化硅不能与碳酸钠溶液发生反应,但在高温下能与碳酸钠固体发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
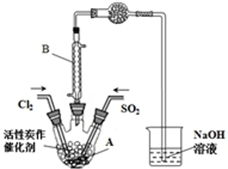 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示. | SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 | / | / |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | … |
| … | C2H6 | C5H12 | C8H18 | … | … | … | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
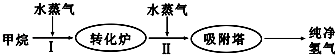
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com