

| ||
| ||
| ||


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)(1)某化学课外研究小组,设计实验探究KI溶液和FeCl3溶液反应存在一定的限度。已知该反应为:2Fe3+ +2I- =2Fe2+ + I2。请完成相关的实验步骤和现象。
可选试剂:①0. 1mol·L -1KI溶液;②0. 1mol·L -1 FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4。
实验步骤:
①取5mL 0. 1mol·L -1 KI溶液,再滴加5~6滴(约0.2ml)0. 1mol·L-1FeCl3溶液
②充分反应后,将溶液分成三份
③取其中一份,滴加试剂CCl4,用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘。
④另取一份,滴加试剂 (填试剂序号),若现象为 ,则说明该反应有一定的限度。
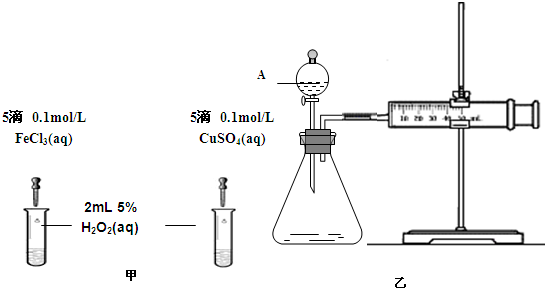
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
①定性分析:如图甲可通过观察 (填现象),定性比较得出结论。有同学提出将FeCl3溶液改为Fe3+浓度相同的Fe2(SO4)3溶液更为合理,其理由是 。
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中一定需要测量的数据是 (填序号)。
①收集40ml气体所需要的时间 ②CuSO4溶液和FeCl3溶液的浓度 ③过氧化氢溶液的浓度
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省铜陵市一中高一下学期期中考试化学试卷(带解析) 题型:实验题
(10分)(1)某化学课外研究小组,设计实验探究KI溶液和FeCl3溶液反应存在一定的限度。已知该反应为:2Fe3+ + 2I- = 2Fe2+ + I2。请完成相关的实验步骤和现象。
可选试剂:①0. 1mol·L-1KI溶液;②0. 1mol·L-1 FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4。
实验步骤:
①取5mL 0. 1mol·L-1 KI溶液,再滴加5~6滴(约0.2ml)0. 1mol·L-1FeCl3溶液
②充分反应后,将溶液分成三份
③取其中一份,滴加试剂CCl4,用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘。
④另取一份,滴加试剂 (填试剂序号),若现象为 ,则说明该反应有一定的限度。
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: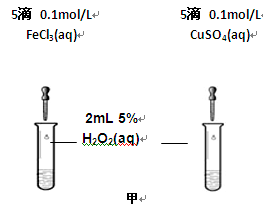
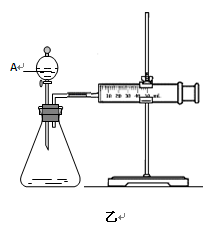
①定性分析:如图甲可通过观察 (填现象),定性比较得出结论。有同学提出将FeCl3溶液改为Fe3+浓度相同的Fe2(SO4)3溶液更为合理,其理由是 。
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中一定需要测量的数据是 (填序号)。
①收集40ml气体所需要的时间②CuSO4溶液和FeCl3溶液的浓度③过氧化氢溶液的浓度
查看答案和解析>>
科目:高中化学 来源:2014届安徽省铜陵市高一下学期期中考试化学试卷(解析版) 题型:实验题
(10分)(1)某化学课外研究小组,设计实验探究KI溶液和FeCl3溶液反应存在一定的限度。已知该反应为:2Fe3+ + 2I- = 2Fe2+ + I2。请完成相关的实验步骤和现象。
可选试剂:①0. 1mol·L -1KI溶液;②0. 1mol·L -1 FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4。
实验步骤:
①取5mL 0. 1mol·L -1 KI溶液,再滴加5~6滴(约0.2ml)0. 1mol·L-1FeCl3溶液
②充分反应后,将溶液分成三份
③取其中一份,滴加试剂CCl4,用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘。
④另取一份,滴加试剂 (填试剂序号),若现象为 ,则说明该反应有一定的限度。
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

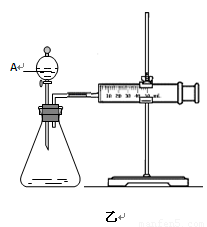
①定性分析:如图甲可通过观察 (填现象),定性比较得出结论。有同学提出将FeCl3溶液改为Fe3+浓度相同的Fe2(SO4)3溶液更为合理,其理由是 。
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中一定需要测量的数据是 (填序号)。
①收集40ml气体所需要的时间 ②CuSO4溶液和FeCl3溶液的浓度 ③过氧化氢溶液的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com