
| A. | 过氧化氢是由氢气和氧气组成的 | |
| B. | 它是由2个氢元素和2个氧元素组成的 | |
| C. | 过氧化氢在二氧化锰作用下能生成水和氧气,该反应为复分解反应 | |
| D. | 每个过氧化氢分子中含有2个氢原子和2个氧原子 |
分析 A、过氧化氢是一种纯净物,由过氧化氢分子构成;
B、过氧化氢是由氢元素和氧元素构成;
C、过氧化氢分解为氧气和水,属于分解反应;
D、1个过氧化氢分子是由2个氢原子和2个氧原子构成.
解答 解:A、过氧化氢是一种纯净物,由过氧化氢分子构成,故A错误;
B、过氧化氢是由氢元素和氧元素构成,1个过氧化氢分子是由2个氢原子和2个氧原子构成,故B错误;
C、过氧化氢分解为氧气和水,属于分解反应,故C错误;
D、每个过氧化氢分子是由2个氢原子和2个氧原子构成,故D正确;
故选D.
点评 本题考查学生对化学式的正确理解,难度不大,正确把握物质的组成以及区分元素和原子的是关键,注意语言描述上的准确性.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
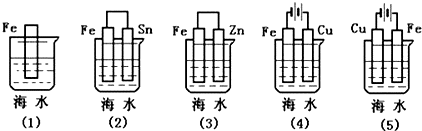
| A. | (5)(2)(1)(3)(4) | B. | (5)(2)(3)(1)(4) | C. | (4)(2)(1)(3)(5) | D. | (4)(2)(1)(5)(3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e;B、D、E都有多种同素异形体,B的化合物种类与A的化合物种类何者最多尚有争议.据此,回答下列有关问题:
现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e;B、D、E都有多种同素异形体,B的化合物种类与A的化合物种类何者最多尚有争议.据此,回答下列有关问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe $\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2═Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓HCl、浓H2SO4、浓HNO3均具有氧化性,都属氧化性酸 | |
| B. | 根据分散系是否有丁达尔效应将分散系分为溶液、胶体和浊液 | |
| C. | NaOH、HNO3、NaNO3在水溶液中均能电离出离子,都属离子化合物 | |
| D. | Na2O2、HCl、BaSO4在熔融状态或溶于水时均能导电,都属电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 两同学为制得纯净的Fe(OH)2,根据如图所示的装置,回答问题.A管中是Fe+H2SO4,B管中是NaOH溶液
两同学为制得纯净的Fe(OH)2,根据如图所示的装置,回答问题.A管中是Fe+H2SO4,B管中是NaOH溶液查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg、Ag | B. | Fe、Mg | C. | Al、Zn | D. | Mg、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ(CO)=0.6 mol/(L•min) | |
| B. | 4 min后,平衡移动的原因可能是向容器中加入了2.0mol的SO2 | |
| C. | 4 min后,若升高温度,SO2物质的量浓度变为0.7mol/L,则正反应为放热反应 | |
| D. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0mol,则平衡时n(SO2)=0.6mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com