
| A. | 3-甲基丁醛 (CH3)2CHCH2COH | B. | TNT | ||
| C. | 硬脂酸甘油酯 | D. | 乙酸甲酯 CH3OOCCH3 |
分析 A.醛基的结构简式为CHO,据此解答即可;
B.TNT:甲苯中甲基邻、对位氢原子易被硝基取代生成2,4,6-三硝基甲苯,其结构简式为: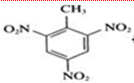 ;
;
C.硬脂酸甘油酯为硬脂酸与甘油形成的酯,结构简式为: ;
;
D.乙酸甲酯 可以写为:CH3OOCCH3,也可以写为:乙酸甲酯 CH3COOCH3.
解答 解:A.醛基的结构简式为-CHO,D中为-COH,故A错误;
B.TNT:甲苯中甲基邻、对位氢原子易被硝基取代生成2,4,6-三硝基甲苯,其结构简式为 ,A中左边硝基应是N原子与苯环相连,故B错误;
,A中左边硝基应是N原子与苯环相连,故B错误;
C.硬脂酸甘油酯为硬脂酸与甘油形成的酯,结构简式为: ,故C错误;
,故C错误;
D.乙酸甲酯可以写为:CH3OOCCH3,也可以写为:乙酸甲酯 CH3COOCH3,故D正确.
故选D.
点评 本题主要考查的是有机物的结构简式,注意官能团的正确表示方法是解决本题的关键,属于中等难度题目.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题
| 部分离子 | Cl- | CO32- | SO42- | NH4+ | Ba2+ |
| c/(mol•L-1) | 无法确定 | 0.2 | 0.1 | 0.4 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.007 5 mol•L-1 | B. | 0.008 mol•L-1 | C. | 0.075 mol•L-1 | D. | 0.08 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子的比例模型示意图: | |
| B. | HCN分子的结构式:H-C≡N | |
| C. | NaHCO3在水中的电离方程式:NaHCO3?Na++H++CO32- | |
| D. | 铝既能与盐酸反应又能与NaOH溶液反应,故铝是两性元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的①CH3COONa、②NaHCO3、③ 三份溶液中的c(Na+):③>②>① 三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | Na2CO3和NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | 等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:2c(K+)=c(X-)+c(HX) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g H2O所含的电子数目为9NA | |
| B. | 0.1mol/L Na2SO4溶液所含Na+数目为0.2NA | |
| C. | 标准状况下22.4 LO2所含的原子数目为NA | |
| D. | 1mol Na完全反应时所失去的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 | B. | 1.7 | C. | 2 | D. | 13.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com