
【题目】可把苯酚、硫氰化钾、乙醛,氢氧化钠四种溶液鉴别出来的试剂是( )
A. FeCl3溶液 B. 碳酸氢钠溶液 C. 乙酸溶液 D. 乙醇
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
B.碳酸钡中加入过量盐酸:CO32-+2H+=CO2↑+H2O
C.偏酸铝钠溶液中加入过量盐酸:AlO2-+4H+=Al3++2H2O
D.铁粉加入到FeCl3溶液中:Fe+Fe3+=2 Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其含碳化合物在人们的生产生活中应用广泛。
(1)将不同量的CO2(g)和H2(g)分别通入到体积为2L的恒容密闭容器中,进行反应2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g),得到如表三组数据;
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
CO2 | H2 | H2 | C2H5OH | |||
1 | 650 | 2 | 6.8 | 2.0 | 0.8 | 6 |
2 | 900 | 2 | 4.4 | 2.0 | 0.4 | 3 |
3 | 900 | 4 | 8.8 | C | d | t |
①实验1中以v(H2)表示的反应速率为________________
②已知在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数称之为化学平衡常数。900℃化学平衡常数为______________,
③如果改变影响平衡的条件之一(如温度,压强,反应物的浓度)平衡将向着能够减弱这种改变的方向移动。则第3组与第2组相比CO2的转化率___________(填“增大”“减小”“不变” 不能确定).
(2)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒). 持续通入甲烷,在标准状况下,消耗甲烷体积VL.
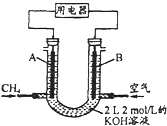
①0<V![]() 44.8L时,负极电极反应为_________________
44.8L时,负极电极反应为_________________
②44.8L<V![]() 89.6L时,电池总反应方程式为_____________
89.6L时,电池总反应方程式为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高( )B
A. 所用NaOH已经潮解 B. 向容量瓶中加水未到刻度线
C. 有少量NaOH溶液残留在烧杯里 D. 称量时误用“左码右物”且使用了游码
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定对工农业及人类生存具有重大意义。
Ⅰ.合成氨是最重要的人工固氮:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)下列关于该反应的说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S>0 D.△H<0,△S<0
(2) —定温度下,在容积为1L的密闭容器中,加入ImolN2和3molH2,反应达到平衡时H2的转化率为60%,则此条件下反应的平衡常数K= (此处不要求写单位);保持容器体积不变,再向容器中加入lmolN2,3molH2反应达到平衡时,氢气的转化率将 (填“增大”、“减小”或“不变”)
(3)标准状况下,若将22.4mL的氨气通入100mLpH为2的盐酸中.则溶液中各离子浓度的顺序由大到小为 。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,充分反应后,过滤所得滤液为(NH4)2SO4溶液,该过程的化学方程式为 。
II.随着研究的不断深入,科学家发明了越來越多有关氮的固定方法。
(5)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现常压、570℃高温的电解法合成氨,提高了反应物的转化率,其实验简图如下,阴极的电极反应式为 。

(6)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:
2N2(g)+6H2O(I) ![]() 4NH3(g)+3O2(g),则其反应热△H= 。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H= 。(已知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g) ![]() 2H2O(I) △H=-571.6kJ·mol-1)
2H2O(I) △H=-571.6kJ·mol-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com