
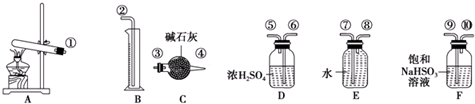
| 实验小组 | 称取CuSO4的质量/g | 装置C增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 2.56 | 224 |
分析 【提出猜想】
猜想Ⅱ.如果有氧气生成,则发生的化学反应是氧化还原反应,则生成的另一种气体应该是SO2;
猜想Ⅲ.硫酸铜受热分解所得气体的成分可能含有SO3、SO2、O2;
(1)实验时,根据反应装置、洗气装置、干燥装置、收集装置进行排序;
(2)若实验结束时装置B中量筒没有收集到水,说明生成的气体完全被吸收;
(3)c装置吸收的是SO2,E装置中收集的气体是O2,根据转移电子配平方程式,
实验一中n(CuSO4)=$\frac{6.4g}{160g/mol}$=0.04mol,n(SO2)=$\frac{2.56g}{64g/mol}$=0.04mol、n(O2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,
根据转移电子守恒知,硫酸铜分解生成n(SO2)=$\frac{0.02mol×4}{2}$=0.04mol,所以该反应中没有SO3生成,
实验二中n(CuSO4)=$\frac{6.4g}{160g/mol}$=0.04mol,n(SO2)=$\frac{3.84g}{64g/mol}$=0.06mol,n(O2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,
根据转移电子守恒知,硫酸铜分解生成n(SO2)=$\frac{0.01mol×4}{2}$=0.02mol<0.06mol,所以生成的气体中含有SO3.
解答 解:【提出猜想】
猜想Ⅱ.如果有氧气生成,则发生的化学反应中有电子转移,所以是氧化还原反应,则生成的另一种气体应该是SO2,因为硫酸和SO3中S元素化合价相同,所以只能是SO2;
猜想Ⅲ.硫酸铜受热分解所得气体的成分可能含有SO3、SO2、O2,
故答案为:SO2、O2;SO3、SO2、O2;
(1)实验时,根据反应装置、洗气装置、干燥装置、收集装置进行排序,A是制取气体、B是量取生成氧气体积、C是吸收二氧化硫、D是干燥氧气、E是排水法收集氧气、F吸收三氧化硫,
其实验先后顺序是制取气体、除去三氧化硫、吸收水分、吸收二氧化硫、吸收二氧化硫、干燥氧气、收集氧气,所以其排列顺序为①→⑨→⑩→⑥→⑤→③→④→⑧→⑦→②,
故答案为:③;④;⑧;⑦;
(2)若实验结束时装置B中量筒没有收集到水,说明生成的气体完全被吸收,因为生成二氧化硫时一定生成氧气,氧气不能被吸收,所以生成的气体只能是三氧化硫,所以I是正确的,故选I,
故答案为:Ⅰ;
(3)c装置吸收的是SO2,E装置中收集的气体是O2,
实验一中n(CuSO4)=$\frac{6.4g}{160g/mol}$=0.04mol,n(SO2)=$\frac{2.56g}{64g/mol}$=0.04mol、n(O2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,
根据转移电子守恒知,硫酸铜分解生成n(SO2)=$\frac{0.02mol×4}{2}$=0.04mol,所以该反应中没有SO3生成,再结合原子守恒配平方程式为2CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2↑+O2↑;
实验二中n(CuSO4)=$\frac{6.4g}{160g/mol}$=0.04mol,n(SO2)=$\frac{3.84g}{64g/mol}$=0.06mol,n(O2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,
根据转移电子守恒知,硫酸铜分解生成n(SO2)=$\frac{0.01mol×4}{2}$=0.02mol<0.06mol,所以生成的气体中含有SO3,根据SO3+2NaHSO3=Na2SO4+2SO2+H2O知,生成n(SO3)=$\frac{0.06mol-0.02mol}{2}$=0.02mol,所以n(SO2):n(SO3):n(O2)=0.02mol:0.02mol:0.01mol=2:2:1,根据原子守恒配平方程式得4CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2SO2↑+2SO3↑+O2↑,
故答案为:2CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2↑+O2↑;4CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2SO2↑+2SO3↑+O2↑.
点评 本题考查性质实验方案设计,侧重考查学生实验操作、分析问题、解答问题能力,明确实验原理是解本题关键,知道实验仪器连接顺序,知道各个仪器中试剂的作用,题目难度中等.


科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
通过乙醇制取氢气通常有如下两条途径:
a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g) ΔH1=+256.6 kJ·mol-1
b.2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g) ΔH2=+27.6 kJ·mol-1
则下列说法正确的是
A.升高a的反应温度,乙醇的转化率增大
B.由b可知:乙醇的燃烧热为13.8 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(g) ΔH=+485.6 kJ·mol-1
D.制取等量的氢气,途径b消耗的能量更多
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性顺序为R>Y>W | |
| B. | R与其他三种元素均能形成共价化合物 | |
| C. | 简单氢化物的热稳定性顺序为R>W>Y | |
| D. | 原子半径次序为W>R>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
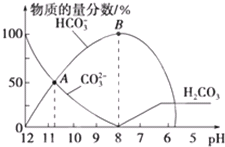
| A. | 当溶液的pH=7时,溶液的总体积为20mL(若忽略溶液混合后体积的变化) | |
| B. | 在0.1mol/L 的Na2CO3溶液中:c(Na+)+c(H+)═c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | 在A点所示的溶液中:c(CO32-)═c(HCO3-)>c(H+)>c(OH-) | |
| D. | 在B点所示的溶液中,浓度最大的阳离子是Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | NH4HSO3受热分解产生的气体全部通入Ba(NO3)2溶液中 | 产生白色沉淀 | 沉淀为BaSO4 |
| B | 浓度均为0.1mol•L-1Zn2+和Cu2+混合溶液中滴入少量Na2S溶液 | 产生黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| C | 2mLpH=3的盐酸和2mLpH=3醋酸,同时分别加入足量相同的锌粉 | 反应速率不同 | 较快的为盐酸 |
| D | 待测液X中加入KSCN溶液无明显现象,加入H2O2酸性溶液 | 溶液变为红色 | X中含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
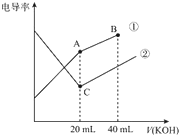
| A. | 曲线①代表0.1 mol/L KOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1 mol/L KOH溶液滴定HCl溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com