
| J | ||||
| R | T |
 .
.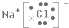 .
.分析 J、L、R、T是原子序数依次增大的短周期主族元素,由J、R、T在周期表中的相对位置可知J在第二同期,R、T在第三周期,J元素最外层电子数是电子层数的2倍,则J最外层电子数是4,J为C,R为S,T为Cl,L与R同周期,且L在该周期中原子半径最大,同周期原子半径从左到右递减,所以L为Na,
根据以上分析可知:J为C、L为Na、R为S、T为Cl.
解答 解:J、L、R、T是原子序数依次增大的短周期主族元素,由J、R、T在周期表中的相对位置可知J在第二同期,R、T在第三周期,J元素最外层电子数是电子层数的2倍,则J最外层电子数是4,J为C,R为S,T为Cl,L与R同周期,且L在该周期中原子半径最大,同周期原子半径从左到右递减,所以L为Na,
根据以上分析可知:J为C、L为Na、R为S、T为Cl.
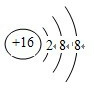
(1)R 2-的离子结构示意图为 ,
,
故答案为: ;
;
(2)氯化钠的电子式为: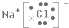 ,
,
故答案为: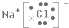 ;
;
(3)实验室用二氧化锰与浓盐酸在加热的条件下制氯气,反应的离子反应方程式为:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)单质氯气与石灰乳反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(5)单质钠与水反应生成氢氧化钠和氢气,化学方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
(6)J为C元素、R为S元素,由J、R形成的液态化合物JR2为CS2,0.2mol CS2在O2中完全燃烧,生成两种气态氧化物为二氧化碳和二氧化硫,放出热量215kJ,
1molCS2在O2中完全燃烧放热的热量为:215kJ×$\frac{1mol}{0.2mol}$=1075kJ,则该反应的热化学方程式为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ•mol-1,
故答案为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ•mol-1.
点评 本题考查了位置结构与性质的关系及其应用,题目难度中等,正确推断元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,明确常见化学用语的书写原则,如:电子式、原子结构示意图、热化学方程式等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 除去乙酸乙酯中的乙酸,用饱和碳酸钠水溶液洗涤后分液 | |
| B. | 用燃烧的方法可以鉴别乙醇、苯和四氯化碳 | |
| C. | 要除去甲烷中的乙烯,可选用溴水 | |
| D. | 甲烷和氯气按体积比1:3混合,可制得纯净的CHCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学变化一定伴随能量变化 | |
| B. | 化学变化一定有化学键的断裂和生成 | |
| C. | 化学变化一定放热 | |
| D. | 化学变化一定有新物质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
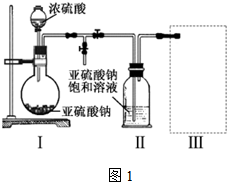
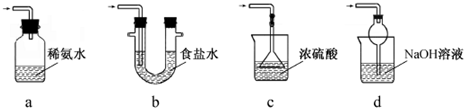

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去暖瓶内的水垢 | B. | 用四氯化碳擦去圆珠笔油渍 | ||
| C. | 用糯米饭、酒曲等自制甜酒酿 | D. | 用烧碱清除炊具上残留的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-二甲基戊烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. | 3,4-二甲基戊烷 | D. | 2,3-二甲基戊烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com