
| A. | 晶体硅常用作半导体材料 | B. | 二氧化硅不能与任何酸反应 | ||
| C. | 硅在地壳中主要以化合态形式存在 | D. | 硅酸可通过硅酸钠与盐酸反应制得 |
科目:高中化学 来源: 题型:解答题
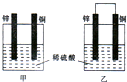 锌是一种较活泼的金属,具有广泛的用途.
锌是一种较活泼的金属,具有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若C(s)+O2(g)=CO2(g)△H1,CO2(g)+C(s)=2CO(g)△H2,2CO(g)+O2(g)=2CO2(g)△H3,则反应热的关系:△H1=△H2+△H3 | |
| B. | 若2H2(g)+O2(g)=2H2O(1)△H4,H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H5,则反应热的关系:△H4=△H5 | |
| C. | 若2SO2(g)+O2(g)=2SO3(g)△H<O,则物质的稳定性:SO2>SO3 | |
| D. | 若断裂1molH2(g)中的H-H键、断裂1 molO2(g)中的共价键分别需要吸收436 kJ、498 kJ的能量,生成H2O(g)中的1 mol H-O键能放出463kJ的能量,则2H2(g)+O2(g)=2H2O(g)△H=-482kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量生产、使用能过滤PM2.5的口罩 | |
| B. | 用石灰对煤燃烧后形成的烟气进行脱硫处理 | |
| C. | 开发利用太阳能、氢能、风能等清洁能源 | |
| D. | 研究廉价、高效的催化剂,以降低汽车尾气中有害物质的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是复分解反应 | B. | NO发生还原反应 | ||
| C. | CO是氧化剂 | D. | 反应物中O得电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
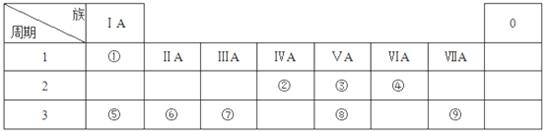
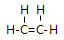 ;由④和⑥两种元素组成的化合物的电子式为
;由④和⑥两种元素组成的化合物的电子式为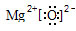 ;元素⑨的原子结构示意图为
;元素⑨的原子结构示意图为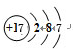 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铜溶液中加入NaHS溶液:Cu2++HS-=CuS↓+H+ | |
| B. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 用强碱溶液吸收工业制取硝酸尾气:NO+NO2+2OH-=2NO3-+H2O | |
| D. | 将少量SO2气体通入氨水中:SO2+NH3•H2O=NH4++HSO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com