
下列有利于反应自发进行的是( )
①反应吸热 ②反应放热 ③反应后熵增加
④反应后熵减小
A.①③ B.②③ C.②④ D.①④
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
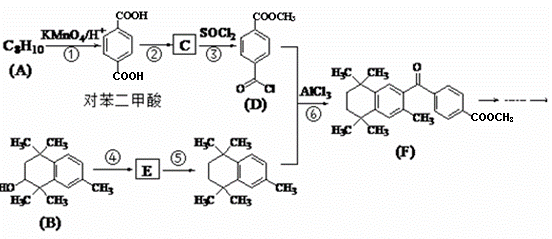 历史上曾将一类从植物胶中取得的具有芳香气味的物质称为芳香族化合物,芳香族化合物大部分具有“芳香性”,有研究者设计利用其特殊性质合成某药物,其合成路线如下(部分反应试剂和条件已略):
历史上曾将一类从植物胶中取得的具有芳香气味的物质称为芳香族化合物,芳香族化合物大部分具有“芳香性”,有研究者设计利用其特殊性质合成某药物,其合成路线如下(部分反应试剂和条件已略):
已知:Ⅰ. 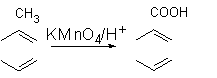
 Ⅱ.
Ⅱ.
试回答下列问题:
(1)原料A的结构简式为 ;原料B发生反应④所需的条件为 。
(2)D的分子式为 ;F分子中含氧官能团的名称为 、 。
(3)反应①、⑥所属的反应类型分别为 、 。
(4)反应②、⑤的化学方程式分别为②______________;⑤______________。
(5)对苯二甲酸有多种同分异构体,符合下列条件的同分异构体有 种,
①苯环上有三个取代基;②能与NaHCO3溶液发生反应;③能发生银镜反应。
写出其中一个同分异构体发生银镜反应并酸化以后的产物的核磁共振氢谱为四组峰,且峰面积比为1:2:2:1的同分异构体的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是________。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③最后通入足量的SO2气体。
请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为______________。
(2)实验③中的现象为__________________。
(3)实验①、②中反应的离子方程式分别是________________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,用等物质的量的A和B发生如 下反应:A(g)+2B(g)
下反应:A(g)+2B(g)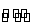
2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则此时A的转化率为( )
A.40% B.50% C.60% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
反应CH3OH (l)+NH3(g)====CH3NH2(g)+H2O(g)在某 温度自发向右进行,若反应|ΔH|=17 kJ·mol-1,|ΔH-TΔS|=17 kJ· mol-1,则下列正确的是( )
温度自发向右进行,若反应|ΔH|=17 kJ·mol-1,|ΔH-TΔS|=17 kJ· mol-1,则下列正确的是( )
A.ΔH >0,ΔH-TΔS<0
B.ΔH <0,ΔH-TΔS>0
C.ΔH >0,ΔH-TΔS>0
D.ΔH <0,ΔH-TΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
除去乙酸乙酯中的乙酸杂质,下列方法可行的是( )
A.加乙醇、浓硫酸,加热
B.加NaOH溶液,充分振荡后,分液
C.直接分液
D.加饱和Na2CO3溶液,充分振荡后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备。
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为________________________。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________________。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为___________________,
该电池总反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
 的同分异构体中含有苯环的还有________种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6∶2∶2∶1的是________________________(写出其中一种的结构简式)。
的同分异构体中含有苯环的还有________种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6∶2∶2∶1的是________________________(写出其中一种的结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com