
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:
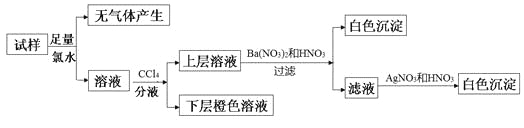
则关于原溶液的判断中正确的是
A. 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B. 无法确定原溶液中是否存在Cl-
C. 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D. 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
【答案】A
【解析】试题分析:无色溶液中一定不含Cu2+,往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成,无SO42-;加足量氯水,无气体,则无CO32-;溶液加四氯化碳分液,下次橙色,则有Br-,上层加硝酸钡和稀硝酸有白色沉淀,有SO32-、无Mg2+;滤液中加硝酸酸化的硝酸银有白色沉淀,但过程中加氯水时引入氯离子,则不能确定是否有Cl-。依据离子浓度都为0.1mol·L-1,根据电荷守恒可推知Na+、K+、NH4+均存在、Cl-一定不存在。据此可得下列结论:A.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响,故A正确;B.根据电荷守恒进行定量分析确定原溶液中一定不存在Cl-,故B错误;C.肯定存在的离子是SO32-、Br-,根据电荷守恒进行定量分析确定原溶液中一定存在Na+、K+,故C错误;D.肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-, NH4+肯定存在,故D错误。故选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
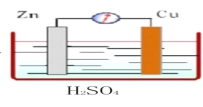
【题目】(1)如图所示,Zn、Cu与稀硫酸形成的原电池装置中,负极材料为 ,负极反应式为 ;正极材料为 ,正极反应式为 。
(2)在下列事实中,各是什么因素影响了化学反应速率?请填写对应序号:
A.催化剂 B.反应物的性质
C.反应温度 D.反应物的浓度
①同浓度、同体积的盐酸放入同样大小的锌粒和镁条,产生气体有快有慢:
②同样大小的石灰石分别与0.1 mol·L-1的盐酸和1 mol·L-1的盐酸反应,速率不同:
③夏天食品容易变质,而冬天不易发生该现象:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 2-甲基丁烷也称异丁烷
B. 三元轴烯( )与苯互为同分异构体
)与苯互为同分异构体
C. C4H9Cl有3种同分异构体
D. 烷烃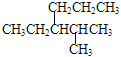 的正确命名是2-甲基-3-丙基戊烷
的正确命名是2-甲基-3-丙基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.根据对角线规则,铍和铝的性质具有相似性
B.在H3O+、NH4+ 和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.P4和CH4都是正四面体分子且键角都为109o28ˊ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如图所示的催化剂循环实现,
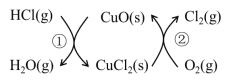
其中,反应①为:2HCl(g) + CuO(s)![]() H2O(g)+CuCl2(s) △H1
H2O(g)+CuCl2(s) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为(反应热用△H1和△H2表示)。
II.氧化锌吸收法常用作脱去冶金工业排放烟气中SO2,其主要步骤如下:配制ZnO悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO(s) + SO2(g)=ZnSO3(s),试回答下列问题:
(1)生成的ZnSO3可热分解处理,其目的是:①生成的高浓度SO2可以用来制备硫酸;②_______________________;
(2)已知:纯ZnO的悬浮液pH约为6.8。用氧化锌吸收法脱去烟气中SO2的过程中,测得pH、吸收效率η随时间t的变化如图1所示。已知被吸收的SO2为c(SO2)吸,溶液中SO32-、HSO3-、H2SO3所占物质的量之比与pH的关系如图2所示。
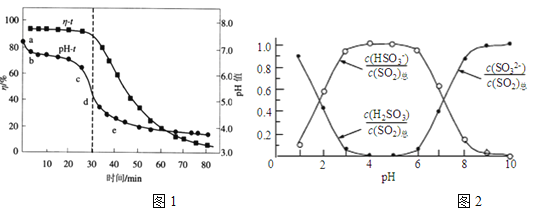
①充分吸收烟气后的混合体系硫元素的主要存在形式是__________________;
②结合图1与图2分析,cd段发生的主要反应是__________________;
③分析图1,ab段的pH迅速下降至6.8左右的原因是______________________;
④为提高SO2的吸收效率η,可采取的措施为___________。
A.增大悬浊液中ZnO的量
B.适当提高单位时间内烟气的循环次数
C.调节溶液的pH至6.0以下
(3)如用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
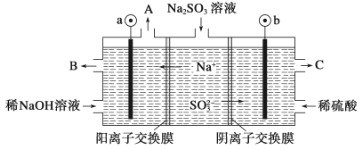
b极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
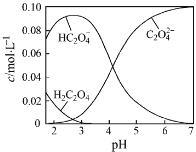
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)>2c(C2O42–)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为( )
A.CCl4与I2分子量相差较小,而H2O与I2分子量相差较大
B.CCl4与I2都是直线型分子,而H2O不是直线型分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
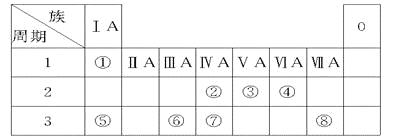
(1) 由②和④组成,造成温室效应的气体的结构式是________
(2) ①、④、⑤、⑧中的某些元素可形成多种既含离子键又含共价键的化合物,写出其中一种化合物的电子式: 。
(3) ④、⑤、⑥的原子半径由大到小的顺序为(填元素符号) 。
(4) ②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式) 。
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为_____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com