
【题目】取100 mL 0.3 mol·L-1和300 mL 0.25 mol·L-1的硫酸配制成500 mL溶液,该混合溶液中H+的物质的量浓度是( )
A. 0.21 mol·L-1 B. 0.42 mol·L-1
C. 0.56 mol·L-1 D. 0.26 mol·L-1
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)在短周期主族元素中,氯及其相邻两元素的电负性由大到小的顺序是(用元素符号表示)
(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为;A、B、C三种元素的原子半径由大到小的顺序是 .
电离能/kJmol﹣1 | I1 | I2 | I3 | I4 |
A | 500 | 4600 | 6900 | 9500 |
B | 740 | 1500 | 7700 | 10500 |
C | 580 | 1800 | 2700 | 11600 |
(3)已知过氧化氢分子的空间结构如图所示, 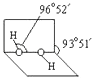 分子中氧原子采取杂化;通常情况下,H2O2与水任意比互溶的主要原因是 .
分子中氧原子采取杂化;通常情况下,H2O2与水任意比互溶的主要原因是 .
(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化: R3+ ![]() R(OH)3
R(OH)3 ![]() [R(OH)4]﹣
[R(OH)4]﹣
①基态R原子的价电子排布式为 .
②[R(OH)4]﹣中存在的化学键是 .
A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4的原子),总电子数或价电子数相等的分子或离子.若将H2O2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H2O2互为等电子体.则A的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.请回答钢铁在腐蚀、防护过程中的有关问题.
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程的电极反应式为:负极 , 正极 .
(2)下列哪个装置可防止铁棒被腐蚀 . 
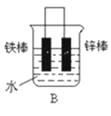
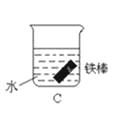
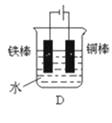
(3)如果镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验.甲同学:向1molL﹣1的FeCl3溶液中加少量NaOH溶液.乙同学:直接加热饱和FeCl3溶液.丙同学:向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热.
试回答下列问题:
a.其中操作正确的同学是 .
b.证明有Fe(OH)3胶体生成的实验操作是 .
c.已知同种胶体微粒带有同种电荷,丁同学将所制得的Fe(OH)3胶体装入U形管内,用石墨作电极,通电一段时间后发现阴极区附近的颜色逐渐变深,这表明Fe(OH)3胶体微粒带(带“正”或“负”)电荷.
(2)某学生欲用98% (ρ=1.84g/cm3)的硫酸配制6.0mol/L的H2SO4溶液950mL,请回答下列问题:
d.实验所用98%的硫酸的物质的量浓度为mol/L.
e.该实验需要使用到的玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管、 .
f.若配制操作定容时,眼睛俯视,则所配制的溶液浓度将(偏大、偏小,无影响?)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将两烧杯用导线相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是( )
A.Cu极附近OH﹣浓度增大
B.Cu极为原电池负极
C.电子流向是由C极流向Pt极
D.当C极上有4mol电子转移时,Pt极上有1mol O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Cu-Zn稀硫酸组成的原电池中,下列叙述正确的是
A. 锌为正极,发生氧化反应
B. 铜为负极,铜片溶解
C. 电子由铜片通过导线流向锌片
D. 铜片上发生的电极反应:2 H + +2e- = H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中X为电源,Y为浸透饱和硫酸钠溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散,下列判断正确的是( )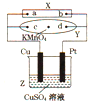
A.c电极的电极反应式为:2H++2e﹣=H2↑
B.Cu电极质量减小,Pt电极质量增大
C.Z中溶液的pH先减小,后增大
D.a为电源正极,b为电源负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放.
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(1)△H=﹣890.3kJmol﹣1N2(g)+O2(g)═2NO(g)△H=+180kJmol﹣1
CH4可用于脱硝,其热化学方程式为:CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(1),△H= .
(2)C2H4也可用于烟气脱硝.为研究温度、催化剂中Cu2+负载量对NO去除率的影响,控制其它条件一定,实验结果如图1所示.为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是 . 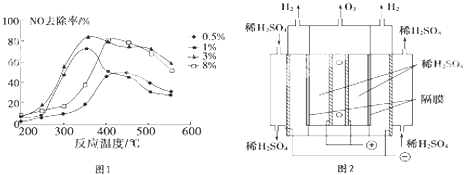
(3)臭氧也可用于烟气脱硝. ①O3氧化NO 结合水洗可产生HNO3和O2 .
②一种臭氧发生装置原理如图2所示.阳极(惰性电极)的电极反应式为 .
③将石墨电极设置成颗粒状的目的是 .
(4)如图3是一种用NH3脱除烟气中NO的原理. 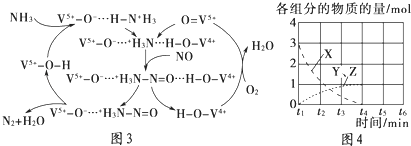
①该脱硝原理中,NO最终转化为(填化学式).
②当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为 .
(5)NO直接催化分解(生成N2与O2)也是一种脱硝途径.在不同条件下,NO的分解产物不同.在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图4所示.写出Y和Z的化学式: .
(6)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2 . 已知9.2g NO2和Na2CO3溶液完全反应时转移电子0.1mol,此反应的离子方程式是;恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中存在的所有离子浓度大小关系是c(Na+)> .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地煤矸石经预处理后含SiO2、Al2O3、Fe2O3 , 一种综合利用煤矸石制取绿矾(FeSO47H2O)的工艺流程如图所示. 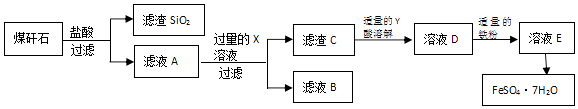
(1)过滤操作需要用到的玻璃仪器除了烧杯、玻璃棒还有 .
(2)滤液B焰色反应呈黄色,试剂X是(用化学式表示)滤渣SiO2可制取木材防火剂,该防火剂的化学式为 .
(3)滤液B中含的阴离子有(写离子符号).
(4)由溶液D转化为溶液E的离子方程式为: .
(5)若在酸性的FeCl2溶液中通入氧气,得到棕黄色溶液,请写出此反应的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com