
【题目】沙利度胺是一种重要的合成药物,具有镇静、抗炎症等作用。有机物H是合成它的一种中间体,合成路线如图(部分反应条件和产物未列出)。

回答下列问题:
(1)A的化学名称为______,E→F的反应类型为______,H中官能团的名称为______。
(2)判断化合物F中有______个手性碳原子。D→E的反应方程式为______。
(3)写出符合下列条件的B的同分异构体______(写出一种即可,不考虑立体异构)
①能与FeC13溶液发生显色反应
②1mol该化合物能与4mol[Ag(NH3)2]OH反应
③其核磁共振氢谱显示有4种不同化学环境的氢
(4)结合上述流程中的信息,写出以1,4-丁二醇为原料制备化合物 的合成路线(其他试剂任选)______。
的合成路线(其他试剂任选)______。
【答案】邻二甲苯 取代反应 羧基、酰胺基 1  +ClCOOC2H5
+ClCOOC2H5![]()
 +HCl
+HCl 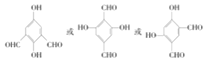 HOCH2CH2CH2CH2OH
HOCH2CH2CH2CH2OH![]() HOOCCH2CH2COOH
HOOCCH2CH2COOH![]()
![]()

【解析】
A的分子式为C8H10,结合B的结构简式,可知A为![]() .对比物质的结构可知,A发生氧化反应生成B,B分子内脱水生成C,D发生取代反应生成E,E发生取代反应生成F,F脱去1分子水生成G,G与氨气发生类似水解反应反应生成H。
.对比物质的结构可知,A发生氧化反应生成B,B分子内脱水生成C,D发生取代反应生成E,E发生取代反应生成F,F脱去1分子水生成G,G与氨气发生类似水解反应反应生成H。
(3)B的同分异构体符合条件:①能与FeC13溶液发生显色反应,说明含有酚羟基,②1mol该化合物能与4mol[Ag(NH3)2]OH反应,说明含有2个醛基,③其核磁共振氢谱显示有4种不同化学环境的氢,说明存在对称结构;
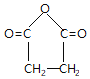
(4)1,4-丁二醇用酸性高锰酸钾溶液氧化生成HOOCCH2CH2COOH,加热脱水生成 ,最后与氨气反应生成
,最后与氨气反应生成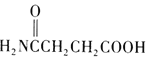 。
。
(1)A为![]() ,A的化学名称为:邻二甲苯。对比E、F的结构可知,E中-COOC2H5被取代生成F,属于取代反应。H中官能团的名称为:羧基、酰胺基,
,A的化学名称为:邻二甲苯。对比E、F的结构可知,E中-COOC2H5被取代生成F,属于取代反应。H中官能团的名称为:羧基、酰胺基,
故答案为:邻二甲苯;取代反应;羧基、酰胺基;
(2)连接4个不同原子或原子团的碳原子为手性碳原子,F中连接N原子、羧基的碳原子为手性碳原子,即F中有1个手性碳原子。D→E的反应方程式为: +ClCOOC2H5
+ClCOOC2H5![]()
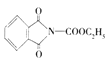 +HCl,
+HCl,
故答案为:1; +ClCOOC2H5
+ClCOOC2H5![]()
 +HCl;
+HCl;
(3)B的同分异构体符合条件:①能与FeC13溶液发生显色反应,说明含有酚羟基,②1mol该化合物能与4mol[Ag ,
,
故答案为: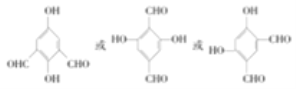 ;
;
(4)1,4-丁二醇用酸性高锰酸钾溶液氧化生成HOOCCH2CH2COOH,加热脱水生成 ,最后与氨气反应生成
,最后与氨气反应生成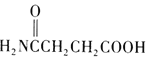 ,和合成路线流程图为::HOCH2CH2CH2CH2OH
,和合成路线流程图为::HOCH2CH2CH2CH2OH![]() HOOCCH2CH2COOH
HOOCCH2CH2COOH![]()

![]()
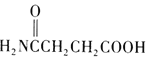 ,
,
故答案为:HOCH2CH2CH2CH2OH![]() HOOCCH2CH2COOH
HOOCCH2CH2COOH![]()

![]()
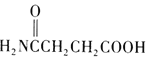 。
。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中进行X2(g)+3Y2(g)![]() 2Z(g)的反应,其X2、Y2、Z的起始浓度依次为0.1 mol/L、0.3 mol/L、0.2 mol/L,当反应达平衡时,各物质的浓度有可能的是 ( )
2Z(g)的反应,其X2、Y2、Z的起始浓度依次为0.1 mol/L、0.3 mol/L、0.2 mol/L,当反应达平衡时,各物质的浓度有可能的是 ( )
A.c(Z)=0.5 mol/LB.c(Z)=0.4 mol/L
C.c(X2)=0.2 mol/L或c(Y2)=0.6 mol/LD.c(Y2)=0.5 mol/L或c(X2)=0.15 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,H2SO3的电离常数:Ka1=1.54×10-2,Ka2=1×10-7.向m mL0.1mo1L-1H2SO3溶液中滴加0.1molL-1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示,下列说法正确的是( )
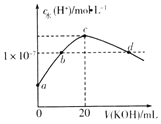
A.m=20
B.c点对应的溶液中存在c(K+)=c(HSO3-)+2c(SO32-)
C.b、d两点溶液的pH=7
D.SO32-+H2OHSO3-+OH-的Kb=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)ETBE(g)△H.回答下列问题:
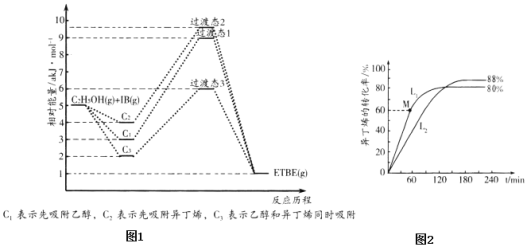
(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图1所示,该反应的△H=______a kJmol-1.反应历程的最优途径是______(填C1、C2或C3)。
(2)在刚性容器中按物质的量之比1:1充入乙醇和异丁烯,在378K与388K时异丁烯的转化率随时间变化如图2所示。
①378K时异丁烯的转化率随时间变化的曲线为______(填L1或L2)。
②388K时,以物质的量分数表示的化学平衡常数K=______。(物质的量分数为某组分的物质的量与总物质的量的比)
③已知反应速率v=v正-v逆=k正x(C2H5OH)x(IB)-k逆x(ETBE),其中秒正为正反应速率,v逆为逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数,计算M点![]() =______(保留到小数点后 1位)。
=______(保留到小数点后 1位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
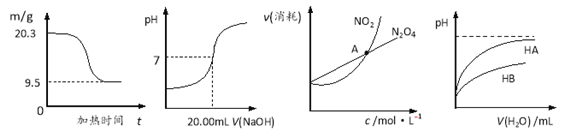
图1 图2 图3 图4
A. 图1表示0.1molMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000 mol·LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol·Lˉ1
C. 图3表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
D. 图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息,得出的结论不正确的是


A. 图1表示常温下向体积为10 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C. 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol-1
D. 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:![]() 石墨
石墨![]()
![]()
![]() 石墨
石墨![]()
则4Fe![]() ______
______
(2)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图1所示:用Z表示的反应速率为______![]() ,写出该反应的化学方程式______,又反应开始到10s时,Y的转化率为______。
,写出该反应的化学方程式______,又反应开始到10s时,Y的转化率为______。

(3)图2为乙烷![]() 燃料电池的装置
燃料电池的装置![]() 、B为多孔碳棒
、B为多孔碳棒![]() :______
:______![]() 填A或
填A或![]() 处电极入口通乙烷,其电极反应式为______。
处电极入口通乙烷,其电极反应式为______。
(4)用中和滴定法测定溶液碱溶液的浓度。
①滴定时,用![]() 的盐酸来滴定待测溶液,若选用甲基橙作指示剂,滴定终点的判断方法是______。
的盐酸来滴定待测溶液,若选用甲基橙作指示剂,滴定终点的判断方法是______。
②下列操作![]() 其他操作正确
其他操作正确![]() 造成测定结果偏低是______
造成测定结果偏低是______
A.滴定终点读数时俯视读数
B.酸式滴定管使用前水洗后未用标准盐酸溶液润洗
C.锥形瓶水洗用待测液润洗
D.酸式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 ℃条件下,在恒容密闭容器中,充入1 mol NO2存在如下平衡:2NO2(g) ![]() N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
A. 平衡向正反应方向移动 B. 平衡常数K增大
C. NO2的转化率变小 D. 容器内气体颜色先变深后变浅,最后比原来还要浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com