
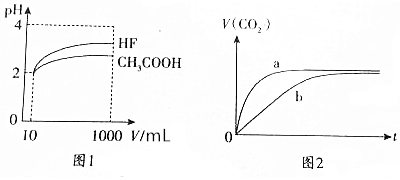
分析 (1)①由图可知,稀释相同的倍数,HF的pH变化程度大,则酸性HF强,电离平衡常数大;
②10mLpH=2的CH3COOH溶液与HF溶液中,氢离子起始浓度相同,则醋酸溶质浓度大于HF酸;
(2)反应速率与氢离子浓度成正比,上述分析可知HF酸性大于醋酸,溶液中氢离子浓度HF中大,反应速率快;
(3)利用盖斯定律将①-②可得氢氟酸的电离方程式及热效应.
解答 解:(1)①根据图象分析知道,起始是两种溶液中c(H+)相同,c(较弱酸)>c(较强酸),稀释过程中较弱酸的电离程度增大,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HF的pH变化比CH3COOH的大,故HF酸性强,电离平衡常数大,
故答案为:大于;稀释相同倍数,HF的pH变化比CH3COOH的大,故HF酸性强,电离平衡常数大;
②体积为10mLpH=2的CH3COOH溶液与HF溶液,HF酸性强,都是弱电解质电离出相同氢离子浓度,则酸弱的浓度大,所以醋酸溶质浓度大于HF溶质浓度,
故答案为:小于;
(2)HF的电离平衡常数大于醋酸,所以HF的反应速率快,b曲线代表醋酸与NaHCO3溶液反应,a曲线是代表HF与NaHCO3溶液反应,
故答案为:HF;
(3)①HF(aq)+OH-(aq)=F-(aq)+H2O(l)△H=-67.7kJ•mol-1,②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1.
利用盖斯定律将①-②可得:HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1,
故答案为:HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1.
点评 本题考查了弱电解质的电离、盐类水解、盖斯定律的运用等知识点,明确弱电解质电离特点及酸的电离平衡常数与酸性强弱的关系是解本题关键,难度中等.


科目:高中化学 来源: 题型:多选题
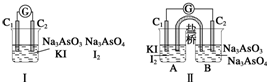
| A. | 甲组操作时,微安表指针不发生偏转 | |
| B. | 甲组操作时,溶液颜色不变 | |
| C. | 乙组操作时,C2作正极 | |
| D. | 乙组操作时,C1上发生的电极反应式为I2+2e-═2I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | w=$\frac{17c}{1000ρ}$ | B. | w=$\frac{17V}{17V+22400}$ | ||
| C. | c=$\frac{1000Vρ}{17V+22400}$ | D. | ρ=$\frac{17V+22400}{22.4+22.4V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 | |
| B. | 漂白粉解决了氯水漂白时不稳定、难以保存、使用不方便、效果不理想的问题 | |
| C. | 钢铁的腐蚀最普遍的是吸氧腐蚀,最终产物为铁锈 | |
| D. | 温度、压强一定时,放热且熵增的反应能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氯气参加氧化还原反应时电子转移数一定是2NA | |
| B. | 常温常压下,56 g Fe与足量的盐酸完全反应转移的电子数为3NA | |
| C. | 同温同压下,等质量的H2和O2的体积之比是16:1 | |
| D. | 1mol的Na2O2固体中含有离子数为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com