
【题目】金刚石和石墨均为碳的同素异形体,氧气不足时它们燃烧生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如图所示。

(1)写出石墨转化为金刚石的热化学方程式____________________________________。
(2)写出石墨和二氧化碳反应生成一氧化碳的热化学方程式_____________________。
(3)科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
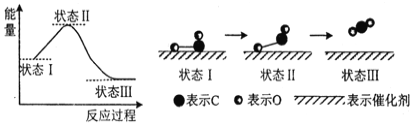
①判断CO和O生成CO2是放热反应的依据是__________________。
②写出CO2的电子式___________________,CO2含有的化学键类型是(若含共价键,请标明极性或非极性)______________________。
【答案】C(s,石墨)=C(s,金刚石)△H=+1.9 kJ/molC(s,石墨)+CO2(g)=2CO(g)△H=+172.5 kJ/mol状态I的能量高于状态III的能量![]() 极性共价键
极性共价键
【解析】
(1)根据图像可知石墨的总能量低于金刚石,石墨转化为金刚石的反应热为+(395.4-283.0-110.5)kJ/mol=+1.9 kJ/mol,因此石墨转化为金刚石的热化学方程式为C(s,石墨)=C(s,金刚石)△H=+1.9kJ/mol。
(2)根据图像可知:
①C(s,石墨)+1/2O2(g)=CO(g)△H=-110.5 kJ/mol
②CO(g)+1/2O2(g)=CO2(g)△H=-283.0 kJ/mol
根据盖斯定律可知①-②即可得到石墨和二氧化碳反应生成一氧化碳的热化学方程式为C(s,石墨)+CO2(g)=2CO(g)△H=+172.5 kJ/mol。
(3)①根据图像可知状态I的能量高于状态III的能量,所以CO和O生成CO2是放热反应。
②二氧化碳是共价化合物,则CO2的电子式为![]() ,碳氧是不同的非金属元素,则CO2含有的化学键类型是极性共价键。
,碳氧是不同的非金属元素,则CO2含有的化学键类型是极性共价键。


科目:高中化学 来源: 题型:
【题目】甲乙两同学对保存已久的Na2SO3试剂进行试验探究。取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解。
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)_____________________________________
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是________________________________
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请写出实验步骤、预期现象和结论。
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸钾溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
实验步骤 | 预期现象和结论 |
步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置。 | |
步骤2:取适量步骤1所得溶液于试管中 加入少量的____________________溶液。 | 若溶液褪色,说明其有_________若溶液不褪色,说明其中没有______ |
步骤3: 再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴 加___________溶液。 | 如果有白色沉淀生成,则说明其中有_____________,已经变质。 如果没有白色沉淀生成,则说明其中 没有_____________ |
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量。实验如下:
①配制250ml 约0.2molL-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入____________,洗涤,定容,摇匀。
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05molL-1酸性高锰酸钾装入50ml__________(填酸式或碱式)滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4VmL。
③计算Na2SO3的质量分数=______________(只列出计算式,不要求算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲探究CO还原CuO,设计如图所示装置(夹持装置略去)。下列说法正确的是
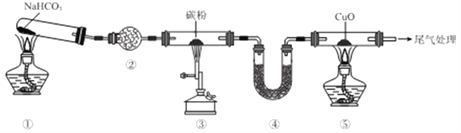
A. ②、④中均可盛装碱石灰
B. 加热的顺序为③、①、⑤
C. ①、③、⑤中均发生氧化还原反应
D. 可将尾气用导管通入到⑤的酒精灯处灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________;
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________;
(3)已知:As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ ![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ ![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________;
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应: ![]() (aq)+I2(aq)+2OH(aq)
(aq)+I2(aq)+2OH(aq)![]()
![]() (aq)+2I(aq)+ H2O(l)。溶液中c(
(aq)+2I(aq)+ H2O(l)。溶液中c(![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。

①下列不可判断反应达到平衡的是__________(填标号);
a.溶液的pH不再变化 b.v(I)=2v(![]() )
)
c.c(![]() )/c(
)/c(![]() )不再变化 d.c(I)=y mol·L1
)不再变化 d.c(I)=y mol·L1
②tm时,v逆_____ v正(填“大于”“小于”或“等于”);
③tn时v逆_____ tm时v逆(填“大于”“小于”或“等于”);
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________;
(5)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图-1和题图-2所示:
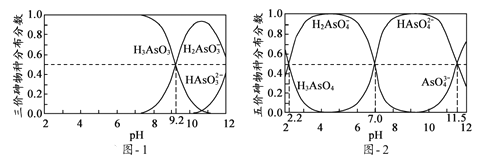
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____________;
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1);
H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1);
(6)溶液的pH对吸附剂X表面所带电荷有影响,pH =7.1时,吸附剂X表面不带电荷;pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题图-3所示:
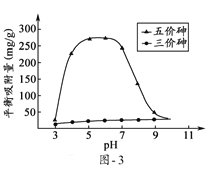
试问,提高吸附剂X对三价砷去除效果可采取的措施是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是( )
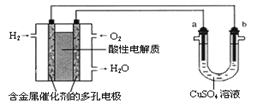
A. 燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种物质,均含同一种元素,一定条件下其转化关系如下(部分产物已略去):
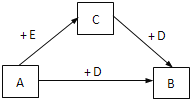
请回答:
(1)若A是短周期元素组成的金属单质,D是短周期中原子半径最大的主族元素形成的氢氧化物。
①组成A的元素在周期表中的位置是_________________。
②当A与D的溶液反应转移1.5 mol电子时,产生气体的体积(标准状况)为____L。
(2)若A是常见金属单质,B的溶液为黄色,D的组成元素的原子M层电子数比L层少1。
①下列关于C的说法正确的是_________(填字母)。
a. 其溶液为无色 b. 遇KSCN溶液变红色
c. 既有氧化性也有还原性 d. 其溶液可用于吸收氯气
②B与HI溶液反应可生成C、E和一种单质,该反应的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家分获,以表彰他们在“分子马达”研究方面的成就,一种光驱分子马达结构如图所示。有关该分子的说法正确的是
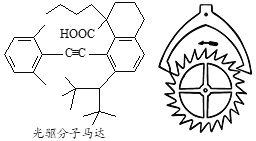
A. 该分子属于芳香烃
B. 两个苯环可以处于同一平面
C. 能与NaHCO3和酸性KMnO4溶液反应
D. 1mol该分子最多可与2molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿粉(主要含有MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制备高纯MnO2的流程如下图所示:
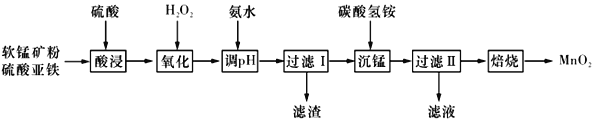
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp [Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子物质的量浓度小于或等于1×10-5mol·L-l时,可视为该金属离子已被沉淀完全。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_____________________。“酸浸”时加入一定量的硫酸,硫酸不能过多或过少。“硫酸”过多造成氨的损失;硫酸过少时,“酸浸”时会有红褐色渣出现,原因是___________________________________。
(2)加入氨水应调节pH的范围为______,当Fe3+恰好沉淀完全时,c(Al3+)=________mol·L-l。
(3)“过滤”所得滤渣为MnCO3,滤液中溶质的主要成分是____________(填化学式),写出其阳离子的电子式:_______________________________。
(4)加入碳酸氢铵产生沉淀的过程称为“沉锰”。
①“沉锰”过程中放出CO2,反哥应的离子方程式为_______________________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_______________________________。
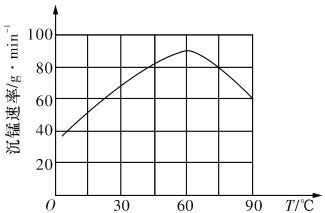
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为83的元素位于:①第5周期;②第6周期;③ⅣA族;④ⅤA族;⑤ⅡB族,其中正确的组合是
A. ②④ B. ②③ C. ①④ D. ①⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com