
| A. | 2 molH2(g)和1molO2(g)的总能量小于2mol H2O (l)的能量 | |
| B. | 1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量 | |
| C. | 1mol H2O (l)变成1mo1 H2O (g),吸收88 kJ能量 | |
| D. | 等质量的H2O (g)比H2O(l)所含能量低 |
分析 已知2H2(g)+O2(g)→2H2O(l)+571.6kJ,2H2(g)+O2(g)→2H2O(g)+483.6kJ,据盖斯定律可得:2H2O(l))=2H2O(g)△H=88kJ•mol-1,1mol液态水转化为气态水应吸热44KJ,以此解答该题.
解答 解:A.氢气与氧气反应放热,反应物能量高于生成物,所以2 molH2(g)和1molO2(g)的总能量大于2molH2O(l)的能量,故A错误;
B.已知2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1,则2H2O(g)=2H2(g)+O2(g)△=483.6KJ/mol,1mol水分解时吸热483.6KJ2=241.8KJ,故B正确;
C.据盖斯定律可得:2H2O(l))=2H2O(g)△H=88kJ•mol-1,1mol水转化应吸热44KJ,故C错误;
D.有C知,水有液态转化为气态要吸收能量,气态时所含能量高,故D错误.
故选B.
点评 本题考查了焓变、盖斯定律、焓变与反应物生成物能量的关系,为高频考点,侧重于基础知识的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将二氧化碳通过过氧化钠使其增重ag 反应中转移电子数为 $\frac{a{N}_{A}}{14}$ | |
| B. | 1mol Cl2 通入水中,则n(HClO)+n(Cl-)+n(ClO-)=2NA | |
| C. | 常温常压下,3克含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| D. | 2.24升的甲烷中含有的C-H键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
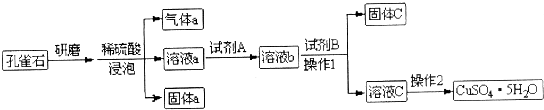
| A. | 研磨孔雀石的目的是增大固体表面积,从而加快反应速率 | |
| B. | 试剂A目的是将溶液中Fe2+转化为Fe3+,可选用双氧水作氧化剂 | |
| C. | 试剂B目的是作pH调节剂,使Fe3+转化为沉淀 | |
| D. | 试剂B可以选择NaOH或氨水等碱性试剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 第2周期 | ① | ② | ||||||
| 第3周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 第4周期 | ⑨ | ⑩ |
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(1{0}^{-8}+1{0}^{-10})}{2}$mol/L | B. | (10-8+10-10)mol/L | ||
| C. | (10-14-5×10-5)mol/L | D. | 2×10-10 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com