
 文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.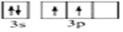 .
.| 化学式 | HClO4 | HClO3 | HClO2 | HClO |
| Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
 ,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.分析 (1)硅原子最外层4个电子,分别位于s和p亚层上,据此写出价电子轨道表示式;
(2)据元素原子核外电子排布分析;
(3)据钠的正电性较强对核外电子的吸引力比氖更强,要想失去电子需要更多的能量,据此进行分析;
(4)①HClO4的分子中H是与O原子结合,各原子均达到稳定结构,其中Cl为+7价,O为-2价.结构式为 ;HClO3中Cl原子的孤对电子数为$\frac{7-2+1}{2}$=3,形成3个σ键,杂化轨道类型为sp3;据氯的含氧酸中非羟基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl-O-H中的电子数更向Cl偏移,越易电离出H+,进行分析;
;HClO3中Cl原子的孤对电子数为$\frac{7-2+1}{2}$=3,形成3个σ键,杂化轨道类型为sp3;据氯的含氧酸中非羟基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl-O-H中的电子数更向Cl偏移,越易电离出H+,进行分析;
②据HF分子与水分子间存在氢键,电离时需要更多能量此分析;据键能大小关系为:HF>HCl>HBr>HI,来分析;
(5)面心立方晶体中原子分布在8个顶点和6个面心,用均摊法计算一个晶胞中Al原子数为4,一个晶胞质量为$\frac{4M}{{N}_{A}}$g,劲爆的体积为q3×10-21cm3,故铝单质的密度为$\frac{\frac{4M}{{N}_{A}}}{{q}^{3}×1{0}^{-21}}$g•cm-3=$\frac{4M}{{N}_{A}×{q}^{3}×1{0}^{-21}}$g•cm-3;
铝晶胞中原子的体积为4×$\frac{4}{3}π{r}^{3}p{m}^{3}$,晶胞的体积为q3×109pm3,故铝晶胞中原子的体积占晶胞体积的百分率为$\frac{4×\frac{4}{3}π{r}^{3}}{{q}^{3}×1{0}^{9}}$,据此进行分析.
解答 解:(1)硅原子14号元素,有三个电子层,最外层4个电子,分别位于s和p亚层上,每个s轨道有两个自旋方向相反的电子,p亚层有两个电子,自旋方向相同,故价电子轨道表示式为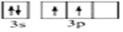 ,
,
故答案为: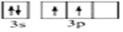 ;
;
(2)铝原子核外电子排排布为[Ne]3s23p1,未成对电子数为1,在第四周期中,与铝未成对电子数相同的金属元素有K[Ar]4s1,Cu[Ar]3d104s1,Ga[Ar]3d104s24p1,Sc[Ar]3d1s2未成对电子数都为1,故有4种金属元素,
故答案为:4;
(3)据钠的正电性较强对核外电子的吸引力比氖更强,要想失去电子需要更多的能量,因此钠的第二电离能比氖的更高,
故答案为:>;
(4)①HClO4的分子中H是与O原子结合,各原子均达到稳定结构,其中Cl为+7价,O为-2价,结构式为 ;HClO3中Cl原子的孤对电子数为$\frac{7-2+1}{2}$=3,形成3个σ键杂化轨道类型为sp3;几种含氧酸的酸性强弱不同,其原因为氯的含氧酸中非羟基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl-O-H中的电子数更向Cl偏移,越易电离出H+,
;HClO3中Cl原子的孤对电子数为$\frac{7-2+1}{2}$=3,形成3个σ键杂化轨道类型为sp3;几种含氧酸的酸性强弱不同,其原因为氯的含氧酸中非羟基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl-O-H中的电子数更向Cl偏移,越易电离出H+,
故答案为: ;sp3;σ键和π键;氯的含氧酸中非羟基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl-O-H中的电子数更向Cl偏移,越易电离出H+;
;sp3;σ键和π键;氯的含氧酸中非羟基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl-O-H中的电子数更向Cl偏移,越易电离出H+;
②HF分子与水分子间存在氢键,电离时需要更多能量;键能大小关系为:HF>HCl>HBr>HI,说明影响△H2递变的因素为键能,
故答案为:HF分子与水分子间存在氢键;键能;
(5)面心立方晶体中原子分布在8个顶点和6个面心,用均摊法计算一个晶胞中Al原子数为4,一个晶胞质量为$\frac{4M}{{N}_{A}}$g,晶胞的体积为q3×10-21cm3,故铝单质的密度为$\frac{\frac{4M}{{N}_{A}}}{{q}^{3}×1{0}^{-21}}$g•cm-3=$\frac{4M}{{N}_{A}×{q}^{3}×1{0}^{-21}}$g•cm-3;
铝晶胞中原子的体积为4×$\frac{4}{3}π{r}^{3}p{m}^{3}$,晶胞的体积为q3×109pm3,故铝晶胞中原子的体积占晶胞体积的百分率为$\frac{4×\frac{4}{3}π{r}^{3}}{{q}^{3}×1{0}^{9}}$,
故答案为:$\frac{4M}{{N}_{A}×{q}^{3}×1{0}^{-21}}$;$\frac{4×\frac{4}{3}π{r}^{3}}{{q}^{3}×1{0}^{9}}$
点评 本题考查价电子轨道表示式、电离能等,侧重考查学生对知识的理解与迁移应用,注意杂化理论的熟练应用,为高频考点,题目难度不大.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
 如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )
如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )| A. | ① | B. | ② | C. | ①② | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5个 | B. | 3个 | C. | 2个 | D. | 1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 88g乙酸乙酯中存在的共价键总数为NA | |
| C. | 加热时,含2molH2SO4的浓硫酸与足量铜反应,转移的电子数为2NA | |
| D. | 1mol羟基所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
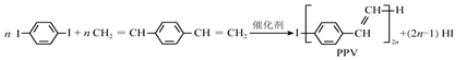
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. | H2C═CH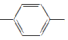 CH═CH2和苯乙烯互为同系物 CH═CH2和苯乙烯互为同系物 | |
| D. | 通过质谱法测定PPV的平均相对分子质量,可得其聚合度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 解释或实验结论 |
| (1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为:90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为:C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)该有机物分子中含有羟基、羧 基各1mol,羟基的电子式为 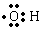 . . |
(4)A的核磁共振氢谱如图: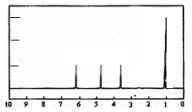 | (4)A中含有4种氢原子. |
(5)综上所述,A的结构简式 , , | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加H2的量 | |
| B. | 将容器体积缩小一半 | |
| C. | 保持容器内体积不变,充入Ar使体系压强增大 | |
| D. | 充入Ar,保持容器内压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
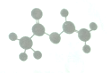 法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖:轮烷是一种分子机器的一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖:轮烷是一种分子机器的一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )| A. | 该化合物的名称为乙酸乙酯 | |
| B. | 该化合物可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同 | |
| C. | 该化合物既能发生取代反应,又能发生加成反应和氧化反应 | |
| D. | 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与盐酸:CO32-+2 H+═H2O+CO2↑ | |
| B. | 向澄清的石灰水中加入过量的小苏打溶液:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 向硝酸亚铁溶液中加入稀硫酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| D. | AlCl3溶液与过量氨水反应:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com