
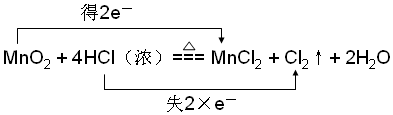
 ĀČ»ÆŃĒķæÓĆÓŚŅ½Ņ©”¢Å©Ņ©”¢Č¾ĮĻ¹¤Ņµ¼°ÓŠ»śŗĻ³É¹¤Ņµ£¬³£×÷ĀČ»Æ¼Į£¬ÖĘļ®ĀČ»ÆŃĒķæ£ØLi/SOCl2£©µē³Ų£®¹¤ŅµÉĻÓĆSO2”¢SCl2ÓėCl2·“Ó¦ŗĻ³ÉSO2£Øg£©+Cl2£Øg£©+SCl2£Øg£©?2SOCl2£Øg£©£»”÷H£¼0£®
ĀČ»ÆŃĒķæÓĆÓŚŅ½Ņ©”¢Å©Ņ©”¢Č¾ĮĻ¹¤Ņµ¼°ÓŠ»śŗĻ³É¹¤Ņµ£¬³£×÷ĀČ»Æ¼Į£¬ÖĘļ®ĀČ»ÆŃĒķæ£ØLi/SOCl2£©µē³Ų£®¹¤ŅµÉĻÓĆSO2”¢SCl2ÓėCl2·“Ó¦ŗĻ³ÉSO2£Øg£©+Cl2£Øg£©+SCl2£Øg£©?2SOCl2£Øg£©£»”÷H£¼0£®| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
·ÖĪö £Ø1£©¢ŁĻņ2LµÄĆܱÕČŻĘ÷ÖŠĶØČėSO2”¢SCl2ÓėCl2¾łĪŖ0.04mol£¬Éč²ĪÓė·“Ó¦µÄĪŖSO2ĪŖx£¬ĮŠČż¶ĪŹ½£¬øł¾ŻĪĀ¶ČĻąĶ¬”¢Ģå»żĻąĶ¬£¬ĘųĢåµÄĪļÖŹµÄĮæÖ®±Č=ĘųĢåµÄŃ¹ĒæÖ®±Č£¬½āµĆx£¬ŌŁÓÉv=$\frac{”÷c}{”÷t}$¼ĘĖć£»
¢ŚIIÓė¢ń±Č½Ļ£¬·“Ó¦ĖŁĀŹ¼Óæģ£¬µ«Ę½ŗāדĢ¬Ņ»Ńł£¬Ó¦ĪŖŹ¹ÓĆ“ß»Æ¼Į£»
£Ø2£©¢Łøł¾Ż»ÆŃ§Ę½ŗā³£ŹżĪŖÉś³ÉĪļÅضČĆŻÖ®»żÓė·“Ó¦ĪļÅضČĆŻÖ®»żÖ®±Č¼ĘĖć£»
¢Śøł¾ŻĪĀ¶Č¶Ō»ÆŃ§Ę½ŗāµÄÓ°Ļģ½įŗĻ¶ŌŹżæÉµĆ£»
£Ø3£©ÓÉ”÷H=·“Ó¦ĪļµÄ×ܼüÄÜ-Éś³ÉĪļµÄ×ܼüÄܼĘĖćæÉµĆ£»
£Ø4£©Õż¼«µĆµē×Ó·¢Éś»¹Ō·“Ó¦£¬½įŗĻ×Ü·“Ó¦²śĪļæɵĆÕż¼«µē¼«·“Ó¦Ź½£»ŃōĄė×ÓŅĘĻņÕż¼«£®
½ā“š ½ā£ŗ£Ø1£©¢ŁĻņ2LµÄĆܱÕČŻĘ÷ÖŠĶØČėSO2”¢SCl2ÓėCl2¾łĪŖ0.04mol£¬Éč²ĪÓė·“Ó¦µÄĪŖSO2ĪŖx£¬Ōņ£ŗ
SO2£Øg£©+Cl2£Øg£©+SCl2£Øg£©?2SOCl2£Øg£©
nŹ¼£ŗ0.04 0.04 0.04 0
n×Ŗ£ŗx x x 2x
nĘ½£ŗ0.04-x 0.04-x 0.04-x 2x
ÓɱķæÉÖŖ£¬4min“ļµ½Ę½ŗā£¬ĪĀ¶ČĻąĶ¬”¢Ģå»żĻąĶ¬£¬ĘųĢåµÄĪļÖŹµÄĮæÖ®±Č=ĘųĢåµÄŃ¹ĒæÖ®±Č£¬Ōņ $\frac{{P}_{Ę½}}{{P}_{Ź¼}}$=$\frac{0.12-x}{0.12}$=$\frac{5.0P0}{6.0P0}$£¬½āµĆx=0.02mol£¬Ōņ·“Ó¦æŖŹ¼ÖĮ“ļµ½Ę½ŗāŹ±£¬v£ØSOCl2£©=$\frac{0.02mol”Į2”Ā2L}{4min}$=0.005mol/£ØL•min£©£»
¹Ź“š°øĪŖ£ŗ0.005mol/£ØL•min£©£»
¢ŚIIÓė¢ń±Č½Ļ£¬“ļµ½Ę½ŗāĖłÓĆŹ±¼ä¶Ī£¬ĖµĆ÷·“Ó¦ĖŁĀŹ¼Óæģ£¬µ«Ę½ŗāדĢ¬Ņ»Ńł£¬Ó¦ĪŖŹ¹ÓĆ“ß»Æ¼Į£»
¹Ź“š°øĪŖ£ŗŹ¹ÓĆ“ß»Æ¼Į£»
£Ø2£©¢Łøł¾Ż£Ø1£©æÉÖŖ£¬373KŹ±£ŗ
SO2£Øg£©+Cl2£Øg£©+SCl2£Øg£©?2SOCl2£Øg£©
cĘ½£ŗ0.01 0.01 0.01 0.02
Ōņ»ÆŃ§Ę½ŗā³£ŹżK=$\frac{0.0{2}^{2}}{0.0{1}^{3}}$=400£¬ŌņAµćµÄŹżÖµĪŖlgK=lg400=2.6£»
¹Ź“š°øĪŖ£ŗ2.6
¢ŚøĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶Č£¬KÖµ¼õŠ”£¬lgK¼õŠ”£¬¹ŹAæÉÄܱä»ÆĪŖB”¢EĮ½µć£»
¹Ź“š°øĪŖ£ŗBE£»
£Ø3£©·“Ó¦S4£Øg£©+4Cl2£Øg£©ØT4SCl2£Øg£©µÄ”÷H=-4kJ•mol-1£¬1molS4£Øg£©”¢1molSCl2£Øg£©·Ö×ÓÖŠ»Æѧ¼ü¶ĻĮŃŹ±·Ö±šŠčŅŖĪüŹÕ1064kJ”¢510kJµÄÄÜĮ棬Éč1molCl2£Øg£©·Ö×ÓÖŠ»Æѧ¼ü¶ĻĮŃŹ±ŠčĪüŹÕµÄÄÜĮæĪŖQ£¬Ōņ”÷H=1064+4”ĮQ-4”Į510=-4£¬½āµĆQ=243£»
¹Ź“š°øĪŖ£ŗ243£»
£Ø4£©Õż¼«µĆµē×Ó·¢Éś»¹Ō·“Ó¦£¬½įÕż¼«µē¼«·“Ó¦Ź½ĪŖ£ŗ2SOCl2+4e-=S+SO2”ü+4Cl-£»ŃōĄė×ÓŅĘĻņÕż¼«£¬ĖłŅŌµē½āÖŹÖŠļ®Ąė×ÓŅĘĻņÕż¼«£»
¹Ź“š°øĪŖ£ŗ2SOCl2+4e-=S+SO2”ü+4Cl-£»Õż¼«£®
µćĘĄ ±¾Ģāæ¼²éĮĖ»ÆŃ§Ę½ŗāµÄÓŠ¹Ų¼ĘĖć£¬ĪĀ¶Č¶Ō»ÆŃ§Ę½ŗāµÄÓ°Ļģ£¬¼üÄÜÓė·“Ó¦ČČµÄ¹ŲĻµŅŌ¼°Ōµē³ŲµÄŌĄķ£¬×ŪŗĻŠŌĒ棬ĢāÄæÄŃ¶Č²»“ó£¬æ¼Éś×¢Ņā»ł“”ÖŖŹ¶µÄ°ŃĪÕÓė¼ĘĖć£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŗ¬ÓŠNAøöŗ¤Ō×ÓµÄŗ¤ĘųŌŚ±ź×¼×“æöĻĀµÄĢå»żŌ¼ĪŖ11.2L | |
| B£® | ŌŚ³£ĪĀ³£Ń¹ĻĀ£¬46g NO2ŗĶN2O4»ģŗĻĘųĢåĖłŗ¬ŃõŌ×ÓŹżÄæĪŖ2NA | |
| C£® | ½«1L 2mol/LµÄFeCl3ČÜŅŗÖĘ³É½ŗĢåŗó£¬ĘäÖŠŗ¬ÓŠĒāŃõ»ÆĢś½ŗĮ£ŹżĪŖ2NA | |
| D£® | ±ź×¼×“æöĻĀ£¬11.2LCCl4ŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ0.5NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğŗÓ±±Ź”øßŅ»ÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Na2CO3Ė×Ćū“æ¼ī£¬ĻĀĆęŹĒ¶Ō“æ¼ī²ÉÓĆ²»Ķ¬·ÖĄą·ØµÄ·ÖĄą£¬²»ÕżČ·µÄŹĒ
A£®Na2CO3ŹĒ¼ī B£®Na2CO3ŹĒŃĪ C£®Na2CO3ŹĒÄĘŃĪ D£®Na2CO3ŹĒĢ¼ĖįŃĪ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğøŹĖąŹ”ø߶žÉĻµŚŅ»“Īѧ¶Īæ¼ŹŌ»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
”°ĀĢÉ«»Æѧ”±µÄÖ÷ŅŖÄŚČŻÖ®Ņ»ŹĒ“Ó¼¼Źõ”¢¾¼ĆÉĻÉč¼ĘæÉŠŠµÄ»Æѧ·“Ó¦£¬Ź¹Ō×Ó³ä·ÖĄūÓĆ£¬²»²śÉśĪŪČ¾Īļ£®ĻĀĮŠ»Æѧ·“Ó¦²»·ūŗĻ”°ĀĢÉ«»Æѧ”±ĄķÄīµÄŹĒ£Ø £©
A£®ÖĘĀČŅŅĶé£ŗCH2=CH2+HCl CH3CH2Cl
CH3CH2Cl
B£®ÖĘ¼×»ł±ūĻ©Ėį¼×õ„£ŗCH3C”ŌCH+CO+CH3OH  CH2=C£ØCH3£©COOCH3
CH2=C£ØCH3£©COOCH3
C£®ÖĘCuSO4£ŗ2Cu+O2 = 2CuO£¬CuO+H2SO4£ØĻ”£©ØTCuSO4+H2O
D£®ÖĘCu£ØNO3£©2£ŗCu+4HNO3£ØÅØ£©ØTCu£ØNO3£©2+2NO2”ü+2H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğøŹĖąŹ”ø߶žÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
ŹŅĪĀĻĀ½«6g CH3COOHČÜÓŚĖ®ÅäÖĘ³É1LµÄČÜŅŗ£¬“ĖČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ £¬¾²ā¶ØČÜŅŗÖŠc£ØCH3COO-£©ÅضČĪŖ1.4”Į10-3mol/L,“ĖĪĀ¶ČĻĀ“×ĖįµÄµēĄėĘ½ŗā³£ŹżK= £¬“ĖŹ±ČÜŅŗÖŠÓÉĖ®µēĄė³öµÄc(H+)Óėc(OH-)Ö®»ż £ØĢī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©1. 0”Įl0?14”£ĪĀ¶ČÉżøߣ¬K½« £ØĢī”°±ä“ó”±»ņ”°±äŠ””±»ņ”°²»±ä”±£©£¬“×ĖįµÄµēĄėĘ½ŗāĻņ_____________ŅĘ¶Æ£ØĢī”°×ó”±»ņ”°ÓŅ”±»ņ”°²»”±£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğøŹĖąŹ”ø߶žÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ÓŠŅ»Ö§50mLĖįŹ½µĪ¶Ø¹ÜĘäÖŠŹ¢ÓŠČÜŅŗ£¬ŅŗĆęĒ”ŗĆŌŚ10mLæĢ¶Č“¦£¬ĻÖ°Ń¹ÜÄŚČÜŅŗČ«²æĮ÷ĻĀÅųö£¬ÓĆĮæĶ²³Š½Ó£¬øĆČÜŅŗµÄĢå»żÓ¦ĪŖ
A£®10mL B£®40mL C£®“óÓŚ40mL D£®Š”ÓŚ40mL
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻąµČ | B£® | ŗóÕߏĒĒ°ÕßµÄ11±¶ | ||
| C£® | ŗóÕߏĒĒ°ÕßµÄ108 | D£® | Ē°ÕߏĒŗóÕßµÄ108 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com