

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
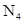 ,
,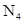 的结构如图所示:有关
的结构如图所示:有关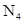 的说法不正确的是( )
的说法不正确的是( )
A.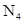 和 和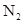 互为同素异形体 互为同素异形体 | B.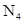 形成的晶体为原子晶体 形成的晶体为原子晶体 |
C.相同质量的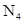 和 和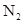 所含原子个数比为1:1 所含原子个数比为1:1 | D. 的摩尔质量是56g·mol-1 的摩尔质量是56g·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 四种分子中,碳原子为sp2杂化的分子是_______________________________________________。
四种分子中,碳原子为sp2杂化的分子是_______________________________________________。 键有_______mol和形成
键有_______mol和形成 键有_______mol。
键有_______mol。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g)ΔH1 反应II:CO(g)+2H2(g)
CH3OH(g)+H2O(g)ΔH1 反应II:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
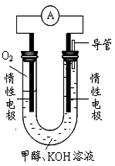
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C60与金刚石一样属于原子晶体 |
| B.干冰升华破坏了共价键 |
| C.共价化合物中一定不含离子键 |
| D.氯化氢溶于水能电离出H+、Cl—,所以氯化氢是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com