

| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
分析 (1)根据v=$\frac{△c}{△t}$计算v(CH4),再利用速率之比等于化学计量数之比计算v(H2);
10min时瞬间甲烷浓度未变,而后浓度减小,改变条件平衡正向移动;
(2)甲为恒温恒容,随反应进行容器内压强增大,乙为恒温恒压,乙等效为在甲平衡的基础上减小压强,平衡正向移动,乙中甲烷的转化率大于甲中,减小压强反应速率减慢,到达平衡时间故甲中长;
(3)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行,进而判断正、逆反应相对大小.
解答 解:(1)反应进行的前5min内,甲烷浓度变化量为(1-0.5)mol/L=0.5mol/L,则v(CH4)=$\frac{0.5mol/L}{5min}$=0.1mol/(L.min),速率之比等于化学计量数之比,则v(H2)=3v(CH4)=0.3mol/(L.min);
10min时瞬间甲烷浓度未变,而后浓度减小,改变条件平衡正向移动,正反应为放热反应,可能是降低温度等,
故答案为:0.3mol/(L.min);降低温度;
(2)甲为恒温恒容,随反应进行容器内压强增大,乙为恒温恒压,乙等效为在甲平衡的基础上减小压强,平衡正向移动,乙中甲烷的转化率大于甲中,减小压强反应速率减慢,到达平衡时间故甲中长,则乙容器中CH4的转化率随时间变化的图象为: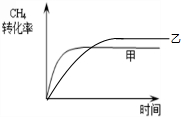 ,
,
故答案为: ;
;
(3)此时浓度商Qc=$\frac{2×2}{0.5×8.5}$=0.94<K=1,反应向正反应进行,故正反应速率大于逆反应速率,
故:大于.
点评 本题考查化学平衡计算,涉及反应速率计算、化学平衡影响因素、平衡常数应用、平衡图象等,注意理解掌握平衡常数的应用.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:多选题
| A. | 不小心将少量浓硫酸沾到皮肤,立即用水冲洗 | |
| B. | 如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液 | |
| C. | 为了避免浪费,应该把实验用剩的药品放回原试剂瓶中 | |
| D. | 连接并组装成套仪器时,一般按自下而上、从左到右的顺序进行安装 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
| 化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是( )
一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是( )| A. | 右边CO与CO2分子数之比为1:3 | |
| B. | 右侧气体密度是相同条件下氢气密度的18倍 | |
| C. | 右侧CO的质量为1.75g | |
| D. | 若隔板处于距离右端$\frac{1}{6}$处,其他条件不变,则前后两次压强之比为25:24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min n/mol | 0min | 2min | 4min | 6min | 8min |
| n(X) | 0.2 | 0.15 | 0.1 | 0.1 | 0.05 |
| n(Y) | 0.6 | 0.45 | 0.3 | 0.3 | 0.5 |
| n(Z) | 0 | 0.1 | 0.2 | 0.2 | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 LCCl4中含Cl原子数目等于0.4NA | |
| B. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| C. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA | |
| D. | 1 mol甲基(-CH3)中含有电子的数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A的晶胞如图所示,已知A相对原子质量为M,晶体密度ρg•cm-3,阿伏伽德罗常数为NA,A元素的原子半径为$\root{3}{\frac{2M}{ρ×{N}_{A}}}$×$\frac{\sqrt{3}}{4}$cm.(用M、ρ、NA表示,不用化简)
A的晶胞如图所示,已知A相对原子质量为M,晶体密度ρg•cm-3,阿伏伽德罗常数为NA,A元素的原子半径为$\root{3}{\frac{2M}{ρ×{N}_{A}}}$×$\frac{\sqrt{3}}{4}$cm.(用M、ρ、NA表示,不用化简)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 25% | C. | 74.4% | D. | 75% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com