
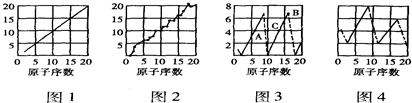
分析 (1)元素的质子数等于该元素的原子序数;原子中中子数与与质子数相近;元素的最高正价等于最外层电子数,且O、F无最高正价,稀有气体化合价为0;
从图4中,可以发现元素原子的某种性质随原子序数的递增而呈周期性变化(小→大);
(2)A的最高正价为+4价,根据正负化合价的绝对值之和等于8计算;
(3)C为+4价为Si元素,B为+7价为Cl元素;
(4)同周期从左到右原子半径依次减小,同一主族从上到下原子半径依次增大.
解答 解:(1)元素的质子数等于该元素的原子序数,则图1中纵轴表示质子数;原子中中子数与与质子数相近,则图2中纵轴表示中子数;元素的最高正价等于最外层电子数,且O、F无最高正价,稀有气体化合价为0,则图3中纵轴表示化合价;从图3中,可以发现元素原子的某种性质随原子序数的递增而呈周期性变化(小→大),故图3纵轴代表得电子能力,
故答案为:中子数;得电子能力;
(2)A的最高正价为+4价,根据正负化合价的绝对值之和等于8可知,其负价为-4价;
故答案为:-4;
(3)C为+4价为Si元素,B为+7价为Cl元素,二者形成的化合物为SiCl4;
故答案为:SiCl4;
(4)同周期从左到右原子半径依次减小,同一主族从上到下原子半径依次增大,所以1~20号元素中,原子半径最大的是(稀有气体除外)K;
故答案为:K.
点评 本题考查结构性质位置关系综合运用,难度中等,注意根据元素周期律分析图象中纵坐标随横坐标的变化关系,侧重于考查学生的读图能力和分析能力.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 制造太阳能电池的材料是单质硅 | |
| B. | 太阳能电池将光能转化为化学能 | |
| C. | 氢氧燃料电池中氢气在负极反应 | |
| D. | 碱性氢氧燃料电池中正极区有OH?生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
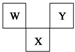 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中正确的是( )| A. | 三种元素的原子半径的大小顺序是W<Y<X | |
| B. | W最高价氧化物对应水化物是强酸,气态氢化物是弱碱 | |
| C. | X元素的氧化物水溶液呈强酸性 | |
| D. | Y元素的单质是非金属单质中唯一能跟水发生剧烈反应的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离出少量氮化硅 | B. | 降低温度 | ||
| C. | 充入氮气 | D. | 充入氦 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 植物油和裂化汽油都能使溴水褪色 | B. | 食用植物油是人体的营养物质 | ||
| C. | 汽油、煤油、卤代烃均为烃 | D. | 甲醛可大量用作食品防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
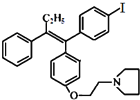 (不考虑立体结构).
(不考虑立体结构).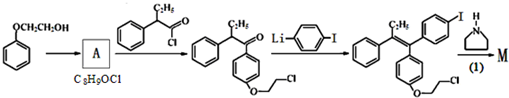
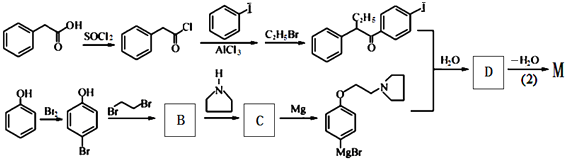
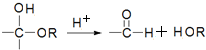
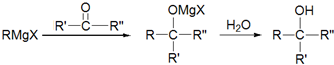
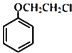 D
D
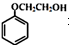 有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有6种.
有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有6种. 中任一种.
中任一种.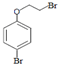 +
+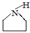 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$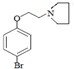 +HBr.
+HBr.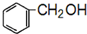 及含二个碳原子的有机化合物为原料,制备芳香醇
及含二个碳原子的有机化合物为原料,制备芳香醇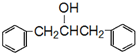 的合成路线
的合成路线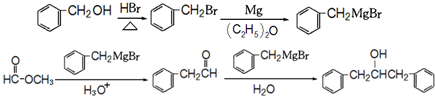 (不超过5步反应).
(不超过5步反应).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com