
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。
已知:①CO的燃烧热△H1=-283kJmol-1
②N2(g)+O2(g)2NO(g) △H2=+183kJmol-1
则写出CO和NO反应生成无污染气体的热化学反应方程式________ 。
(2)一定压强下,在容积为2L的密闭容器中充入1molCO与2molH2,在催化剂作用下发生反应:CO(g)+2H2(g)CH3OH(g) △H ,CO转化率与温度和压强的关系如下图所示。
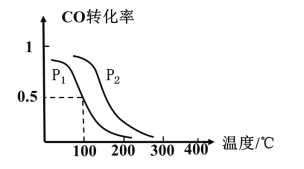
①反应的△H____ 0 ,p1___ p2(填>、< 或=)
②100℃时,反应进行了10秒达到平衡状态,用CO表示该反应的化学反应速率是______ ,该反应的化学平衡常数K=____ 。
③下列说法正确的是______。
A.若容器内气体密度恒定,反应达到平衡状态 B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,△H>0 D.反应中,催化剂使平衡向正反应方向移动
【答案】2NO(g)+2CO(g)=N2(g)+CO2(g) △H=-749 kJmol-1 < < 0.025molL-1s-1 K=4 B
【解析】
(1)已知:①CO的燃烧热 CO(g)+![]() O2(g)=CO2(g)△H1=-283kJmol-1;
O2(g)=CO2(g)△H1=-283kJmol-1;
②N2(g)+O2(g)=2NO(g)△H2=+183kJmol-1;
盖斯定律计算①×2-②得到NO和CO反应生成无污染性气体的热化学反应方程式;
(2)①升高温度,一氧化碳的转化率减小,据此判定该反应的△H;温度不变时,增大压强,平衡右移,一氧化碳转化率增大,据此判定p2与p1大小;
②据图象中一氧化碳转化率,结合“三段式”进行反应速率和化学平衡常数K的计算;
③A.混合气体质量不变,气体体积不变,混合气体密度不变;
B.反应达到平衡状态时各物质的含量不变;
C.根据①中分析判断;
D.催化剂不改变平衡。
(1)已知:①CO的燃烧热 CO(g)+![]() O2(g)=CO2(g)△H1=-283kJmol-1;
O2(g)=CO2(g)△H1=-283kJmol-1;
②N2(g)+O2(g)=2NO(g)△H2=+183kJmol-1;
盖斯定律计算①×2-②得到NO和CO反应生成无污染性气体的热化学反应方程式:2NO(g)+2CO(g)=N2(g)+CO2(g) △H=-749 kJmol-1;
(2)①升高温度,一氧化碳的转化率减小,则正反应为放热反应,反应的△H小于0;温度不变时,增大压强,平衡右移,一氧化碳转化率增大,由图可知相同温度下,p2时CO的转化率大于的p1转化率,故p1<p2;
②在容积为2L的密闭容器中充入1mol CO与2mol H2,100℃时,该反应的CO的转化率为0.5,列三段式,

则反应进行了10秒,用CO表示该反应的化学反应速率=![]() =0.025 molL-1s-1,化学平衡常数K=
=0.025 molL-1s-1,化学平衡常数K=![]() =4;
=4;
③A.容器内混合气体总质量不变,恒容气体体积不变,则密度始终不变,不能判断反应达到平衡,故A错误;
B.容器内各气体浓度恒定,是反应达到平衡状态的特征标志,故B正确;
C.根据①中分析,升高温度,一氧化碳的转化率减小,则正反应为放热反应,反应的△H<0,故C错误;
D.催化剂只改变反应速率,不影响化学平衡移动,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论都正确的是 ( )
选项 | 实验操作 | 现象 | 结论 |
A | 将石蜡油分解产生的气体通入酸性高锰酸钾溶液中 | 紫红色溶液变无色 | 石蜡油裂解一定产生了乙烯 |
B | 用水浸过的棉花包裹铁粉放入试管并加热,将气体通入四氯化碳溶液中 | 四氯化碳中产生气泡 | 铁粉与水蒸气在高温下一定产生了氢气 |
C | 向重铬酸钾溶液中滴加乙醇 | 橙红色溶液变绿色 | 乙醇表现出还原性 |
D | 向2ml0.1mol/L的AgNO3溶液中先滴加2滴0.1mol/L NaCl溶液,再滴入 | 先产生白色沉淀,后沉淀变成黄色 | 相同温度下,AgCl在水中的溶解度大于AgI的溶解度 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是
A.图 可表示石灰石分解反应的能量变化
可表示石灰石分解反应的能量变化
B.图 可表示酶催化反应的反应速率随反应温度的变化
可表示酶催化反应的反应速率随反应温度的变化
C.图 可表示在一定条件的可逆反应中,正反应速率和逆反应速率随时间的变化
可表示在一定条件的可逆反应中,正反应速率和逆反应速率随时间的变化
D.图 可表示向H2SO4溶液中滴加Ba(OH)2溶液,溶液的导电性随碱溶液体积的变化
可表示向H2SO4溶液中滴加Ba(OH)2溶液,溶液的导电性随碱溶液体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与对应的方程式不符合的是
A. 硫化氢溶液呈酸性:H2S ![]() 2H++S2–
2H++S2–
B. “NO2球”浸泡在冷水中,颜色变浅:2NO2(g) (红棕色) ![]() N2O4 (g) (无色) ΔH<0
N2O4 (g) (无色) ΔH<0
C. 甲烷的燃烧热ΔH=–890.3 kJ·mol–1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=–890.3 kJ·mol–1
D. 硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32–+2H+=S +SO2 +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 A、B、C、D 的原子序数依次递增,它们的核电荷数之和 32,原子最外层电子数之和为 10,A与 C同主族,B与 D同主族,A、C原子最外层电子数之和等于 B 原子的次外层电子数,则下列叙述中正确的是
A.一定条件下,B 单质能置换出 D 单质,C 单质能置换出 A 单质
B.四种元素的原子半径:r(A)<r(B)<r(C)<r(D)
C.B、D 的最高价氧化物中,B、D 与氧原子均为双键
D.D 元素处于元素周期表中第 3 周期第Ⅳ族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钠是一种基础化工原料。
(1)已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(l) ΔH=-186 kJ·mol-1,3ClO-(aq)=ClO3— (aq)+2Cl-(aq) ΔH=-113 kJ·mol-1,则:3Cl2(g)+6OH-(aq)=ClO3—(aq)+5Cl-(aq)+3H2O(l)ΔH=____kJ·mol-1,该反应中生成1molClO3—,转移电子数为____。
(2)工业上采用无隔膜电解饱和食盐水可制备氯酸钠。该工艺过程中,生成氯酸钠的相关反应为:Cl2+H2O![]() H++Cl-+HClO,HClO
H++Cl-+HClO,HClO![]() H++ClO-,2HClO+ClO-=ClO
H++ClO-,2HClO+ClO-=ClO![]() +2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。
+2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。

①电解过程中,为按化学计量数比反应,需控制电解液的pH约为___(填序号)。
A.5 B.6.8 C.7.2D.7.5
②若电解液碱度过大,阳极会有较多的O2放出,电极反应方程式为____。已知:Cr2O72—+H2O![]() 2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
③若电解液pH<5时,溶液中HClO浓度会随pH减小迅速降低,其原因是____(用离子方程式表示)。
(3)电解时须对电解槽进行冷却处理以防止电解液温度过高的原因是____。
(4)氯酸钠与硫酸酸化的双氧水溶液反应常用于制备饮用水消毒剂ClO2(g),该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列5种有机物:
① HCOOCH3 ② CH3COOH ③ CH3—CH=CH2 ④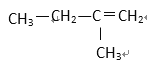 ⑤
⑤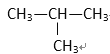
(1) 其中符合通式CnH2n+2的是________ ( 填序号,下同 ), 与 ①互为同分异构体的是_________,与 ③ 互为同系物的是___________
(2) 用系统命名法给 ⑤ 命名,其名称为 _________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是( )
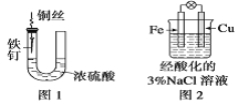
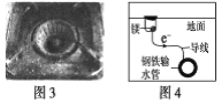
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D、图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com