
【题目】在恒温、恒容的密闭容器中进行反应A(g)+B(g)![]() C(g),若反应物A的浓度从2 mol·L-1降到0.8 mol·L-1需20 s,则反应物A的浓度由0.8 mol·L-1降到0.2 mol·L-1所需的反应时间( )
C(g),若反应物A的浓度从2 mol·L-1降到0.8 mol·L-1需20 s,则反应物A的浓度由0.8 mol·L-1降到0.2 mol·L-1所需的反应时间( )
A. 等于10 sB. 大于10 sC. 小于10 sD. 无法判断
【答案】B
【解析】
先根据![]() 计算反应物的浓度由2
计算反应物的浓度由2 ![]() mol/L降到0.8mol/L时的平均反应速率,再假设以相同的反应速率根据
mol/L降到0.8mol/L时的平均反应速率,再假设以相同的反应速率根据![]() 计算反应物的浓度由0.8 mol/L降到0.2mol/L所需反应时间,实际上化学反应进行过程中,反应物不断被消耗,浓度逐渐降低,反应速率逐渐变慢,据此分析解答。
计算反应物的浓度由0.8 mol/L降到0.2mol/L所需反应时间,实际上化学反应进行过程中,反应物不断被消耗,浓度逐渐降低,反应速率逐渐变慢,据此分析解答。
反应物的浓度由2mol/L降到0.8mol/L时的平均反应速率![]() =
= ![]() = 0.06 mol/(Ls),假设以0.06mol/(Ls)的反应速率计算反应物A的浓度由0.8mol/L降到0.2mol/L所需反应时间
= 0.06 mol/(Ls),假设以0.06mol/(Ls)的反应速率计算反应物A的浓度由0.8mol/L降到0.2mol/L所需反应时间![]() =
=![]() =10s,实际上A物质的化学反应速率是随着物质浓度的减小而减小,所以反应物的浓度由0.8mol/L降到0.2mol/L时的平均反应速率小于0.06mol/(Ls),所以所用时间应大于10s;B项正确,
=10s,实际上A物质的化学反应速率是随着物质浓度的减小而减小,所以反应物的浓度由0.8mol/L降到0.2mol/L时的平均反应速率小于0.06mol/(Ls),所以所用时间应大于10s;B项正确,
答案选B。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】某有机物在氧气里充分燃烧,生成的CO2和H2O的物质的量之比为1∶1,由此可以得出该有机物( )
A.分子中肯定只含C、H两种元素
B.分子中C和H的个数比为1∶2
C.分子中肯定含有氧原子
D.分子中C、H、O的个数比为1∶2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】皂化反应实验的操作步骤如下:
①在小烧杯中加入约5 g 新鲜的动物脂肪(如牛油)和6 mL 95%的乙醇,微热使脂肪完全溶解;
②在①的混合液中加入6 mL 40%的氢氧化钠溶液,边搅拌边加热,直至反应液变成黄棕色黏稠状;
③用玻璃棒蘸取反应液,滴入装有热水的试管中,振荡,若无油滴浮在液面上,说明反应液中油脂已完全反应,否则要继续加热使之反应完全;
④在另一只烧杯中加入60 mL 热的饱和食盐水,把得到的反应液倒入食盐水中,搅拌,观察浮在液面上的固体物质,取出,用滤纸或纱布吸干,挤压成块,并与日常使用的肥皂比较去污能力的大小。
根据上面的实验步骤,请回答下列问题:
(1)加入乙醇的原因是_______________________________________。
(2)请写出硬脂酸甘油酯发生皂化反应的化学方程式:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中的离子,能在溶液中大量共存的是( )
A.Na+、K+、SO42- 、NO3-B.K+、Ca2+、CO32- 、NO3-
C.Na+、NH4+、Cl- 、OH-D.Na+、H+ 、OH- 、Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数之和为46,它们在周期表中的相对位置如图所示。下列说法正确的是
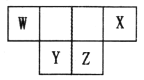
A. 原子半径大小顺序为:Y>Z>X
B. X元素最高价氧化物的水化物酸性最强
C. Y元素的简单氢化物稳定性最强
D. Z单质难溶于化合物WZ2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6 mol A气体和5 mol B气体混合放入4 L密闭容器中,在一定条件下发生反应:
3A(g)+B(g)![]() 2C(g)+xD(g)。经5 min达到平衡,此时生成2 mol C,测定知D的平均反应速率为0.1 mol/(L·min),下列说法中错误的是
2C(g)+xD(g)。经5 min达到平衡,此时生成2 mol C,测定知D的平均反应速率为0.1 mol/(L·min),下列说法中错误的是
A.x=2
B.B的转化率为20%
C.平衡时A的浓度为0.75 mol/L
D.恒温达到平衡时容器内压强为开始时的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,加入1 mol CO和1 mol H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
A. 在该温度下平衡常数K=1
B. 平衡常数与反应温度无关
C. CO的转化率为50%
D. 其他条件不变改变压强平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 是原子序数依次增大的五种常
见元素,其中 A 是原子半径最小的元素,B 元素的一种核素可用于考古断代,D 元素的 s轨道和 p 轨道上的电子数相等且有2个未成对电子;E 是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。请用元素符号或化学式回答下列问题:
(1)A、B、C、D 四种元素中,电负性最大的是________,第一电离能最大的是________。
(2)化合物 CA3 的沸点比化合物 BA4 的高,其主要原因是___________________________ 。
(3)A、B 形成的化合物与氢氰酸(HCN)反应可得丙烯腈(H2CCHCN),丙烯腈分子中的碳原子轨道杂化类型是__________。
(4)由 C 元素形成的一种离子与 BD2 互为等电子体,该离子的结构式为__________。
(5)基态 E 原子的核外电子排布式为:_____________________________;D、E 形成的某种化合物的晶胞结构示意图如下,该晶体的化学式为__________。

(6)向 E 的硫酸盐溶液中通入过量的 CA3,可生成[E(CA3)4]2+,1 mol [E(CA3)4]2+中含有σ 键的数目约为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题越来越受到人们的重视,研究表明氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。

回答下列问题:
(1)![]() 的电子式为____________,
的电子式为____________,![]() 中含有的化学键是____________。
中含有的化学键是____________。
(2)下列关于雾霾的叙述错误的是______(填序号):
A.雾霾中含有硝酸铵和硫酸铵 B.![]() 是形成无机颗粒物的催化剂
是形成无机颗粒物的催化剂
C.雾霾的形成与过度施用氮肥有关 D.雾霾的形成过程涉及氧化还原反应
(3)预防含硫化合物雾霾生成的方法之一是将氨气和二氧化硫通入水中,再充入![]() 充分反应生成一种正盐,该反应的化学方程式为_________。
充分反应生成一种正盐,该反应的化学方程式为_________。
(4)在有氧条件下,催化剂能催化![]() 与
与![]() 反应生成
反应生成![]() 。将一定比例的
。将一定比例的![]() 、
、![]() 和
和![]() 混合气体匀速通入装有催化剂的反应器中反应,测得反应温度高于380℃时,
混合气体匀速通入装有催化剂的反应器中反应,测得反应温度高于380℃时,![]() 的去除率迅速下降,其原因之一是催化剂活性下降,另一重要原因是____________。在无氧条件下,反应器中
的去除率迅速下降,其原因之一是催化剂活性下降,另一重要原因是____________。在无氧条件下,反应器中![]() 能将
能将![]() 还原为
还原为![]() ,当生成
,当生成![]() 时转移电子______
时转移电子______![]() (可用分数表示)。
(可用分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com