
【题目】A、B、C、D、E五种元素的原子序数依次增大,A原子无中子,B的单质在空气中含量最多,C、D元素同主族且原子序数D为C的二倍,E元素的价电子排布式为(n-l)dn+6ns1。回答下列问题:
(1)元素B在周期表中的位置是___________________;E元素的元素符号为_______,
(2)D元素基态原子的价电子轨道排布图为_______。
(3)A元素与C元素形成两种常见的化合物,其原子个数比分别为2:1和1:1,两种化合物可以任意比互溶,主要原因是_____________________;其中一种化合物可在酸性条件下将KMnO4还原为Mn2+,相关反应的离子方程式为____________________。
【答案】 第2周期第VA族(第二周期第五主族) Cu ![]() 相似相溶,分子间形成氢键 5H2O2 +2MnO4-+6H+====2Mn2++5O2↑+8H2O
相似相溶,分子间形成氢键 5H2O2 +2MnO4-+6H+====2Mn2++5O2↑+8H2O
【解析】A、B、C、D、E五种元素的原子序数依次增大,A原子无中子则A为氢元素,B的单质在空气中含量最多则B为氮元素,C、D元素同主族且原子序数D为C的二倍则C为氧元素,D为硫元素,E元素的价电子排布式为(n-l)dn+6ns1即3d94s1,则E为铜元素;(1)元素B为氮元素,在周期表中的位置是第二周期第VA族;E为铜元素,元素符号为Cu;(2)D为硫元素,硫原子的最外层电子排布式3s23p4,价层电子轨道排布图为:![]() ;(3)A元素与C元素形成两种常见的化合物,其原子个数比分别为2:1和1:1分别为H2O和H2O2,两种化合物可以任意比互溶,主要原因是相似相溶,分子间形成氢键;其中一种化合物H2O2可在酸性条件下将KMnO4还原为Mn2+,相关反应的离子方程式为5H2O2 +2MnO4-+6H+====2Mn2++5O2↑+8H2O。
;(3)A元素与C元素形成两种常见的化合物,其原子个数比分别为2:1和1:1分别为H2O和H2O2,两种化合物可以任意比互溶,主要原因是相似相溶,分子间形成氢键;其中一种化合物H2O2可在酸性条件下将KMnO4还原为Mn2+,相关反应的离子方程式为5H2O2 +2MnO4-+6H+====2Mn2++5O2↑+8H2O。


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关下图中有机物的说法不正确的是
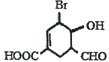
A. 该有机物的分子式为C8H9O4Br
B. 1mol该有机物最多可以与3molH2反应
C. 能发生酯化反应、水解反应、银镜反应和缩聚反应
D. 1mol该有机物与NaOH溶液反应时,最多消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22﹣存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )

A. 1 个 Ca2+周围距离最近且等距离的 C22﹣数目为 6
B. 该晶体中的阴离子与F2是等电子体
C. 6.4 g CaC2晶体中含阴离子0.1 mol
D. 与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要480mL,0.5mol/L的稀硫酸,现欲用98%的浓硫酸(ρ=1.84g/cm3 )配制,配制步骤包括:①计算所用浓硫酸的体积②转移③定容、上下颠倒摇匀④量取一定体积的浓硫酸⑤洗涤并转移⑥稀释并冷却至室温⑦轻摇混匀。完成下列问题:
(1)正确的操作顺序为(填入序号)________。选用的主要仪器有:量筒、烧杯、玻璃棒、________、________。
(2)应量取浓硫酸的体积为________;量取浓硫酸所用的量筒的规格是________(从下列中选用,填字母 A.10 mL B.25 mL C.50 mL D.100 mL);第⑥步中稀释实验的操作方法是________。
(3)下列关于容量瓶的使用方法中,正确的是________。
A.使用前要检验是否漏水
B.在容量瓶中直接溶解固体或稀释液体
C.溶液未经冷却即注入容量瓶中
D.向容量瓶中转移溶液要用玻璃棒引流
(4)下列情况中,所配制的稀硫酸浓度偏大的是________。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视刻度线
E.用量筒量取浓硫酸时仰视刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子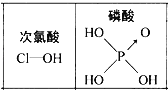
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol/LNa2CO3溶液1L所含阴离子数目小于0.1NA
B. 常温常压下,3.2gCH4中含有的电子数为2NA
C. 1molCl2溶于足量的水中,反应时斯裂的Cl-Cl键数目为NA
D. 标准状况下,11.2LCH3CH2OH中含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十九大报告指出:要持续实施大气污染防治行动,打赢蓝天保卫战。当前空气质量检测的主要项目除了PM2.5外,还有CO、SO2、氮氧化物(NO和NO2)、O3等气体。
(1)汽车尾气中含有NO和CO气体,可利用催化剂对CO、NO进行催化转化反应:
2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
①已知下列热化学方程式:
N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) △H2=-2210kJ/mol
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol
则△H=_________。
②在一定温度下,将2.0molNO、2.4molCO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如下图所示。在0~15min,以N2表示的该反应的平均速度v(N2)=________。若保持反应体系温度不变,20min时再容器中充入NO、N2各0.4mol,化学平衡将_____移动(填“向左”“向右”或“不”)。

(2)在相同温度下,两个体积均为1L的恒容密闭容器中,发生CO、NO催化转化反应,有关物质的量如下表:
容器编号 | 起始物质的量/mol | 平衡物质的量/mol | |||
NO | CO | N2 | CO2 | CO2 | |
I | 0.2 | 0.2 | 0 | 0 | a |
II | 0.3 | 0.3 | b | 0.1 | 0.2 |
①容器I中平衡后气体的压强为开始时的0.875倍,则a=________。
②容器II平衡时的气体压强为p,用平衡分压代替平衡浓度表示的平衡常数K为________。
(3)汽车使用乙醇汽油并不能破少NOx的排放。某研究小组在实验室以耐高温试剂Ag-ZSW-5对CO、NO催化转化进行研究。测得NO转化为N2的转化率随温度CO混存量的变化情况如图所示。

①在n(NO)/n(CO)=1条件下,最佳温度应控制在_______左右。
②若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为________。
③加入CO后NO转化为N2的转化率增大的原因是_______ (用平衡移动的原理解释)。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电极反应式为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因为该反应为放热反应,故不必加热反应就可以发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )
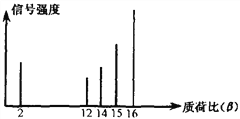

A. 甲醇 B. 丙烷 C. 甲烷 D. 乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com