
| A、Ba(OH)2溶液与Na2SO4溶液:pH=13 | B、醋酸与CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | C、Na2CO3溶液与NaHCO3溶液:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) | D、Na2CO3溶液与NaOH溶液:c(Na+)>c(CO32-)>c(OH-)>c(H+) |
| 0.1mol/L×2 |
| 2 |
| 10-14 |
| 0.1 |


科目:高中化学 来源:2013-2014学年山东省济南市高三3月模拟考试理综化学试卷(解析版) 题型:填空题
(16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是?? ??????????? 。
已知:a.2CO(g)+O2(g)=2CO2(g)??? △H =-566.0 kJ·mol-1
b.CH4(g)+2O2(g)=CO2(g)+2H2O(g)?? △H =-890.0 kJ·mol-1
则CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的热化学方程式为 ??????????????????????????????????? 。
(2)工业上合成氨气的反应为:N2(g)+3H2(g) 2NH3(g)? △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g)? △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(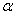 )与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
)与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
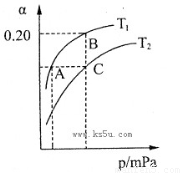
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= ???? L2·mol-1。
②平衡状态由A变到C时,对应的平衡常数K(A)??? K(C)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.210-8 | K=0.13 | Kl=4.210-7 K2=5.610-11 |
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为? ??? >????? > ??? > ???????? 。
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为 ??????? ? 。
③25℃时,为证明HClO为弱酸,某学习小组的同学没计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是??? (填下列各项中序号)。
a.用pH计测量0.1 mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c、用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com