
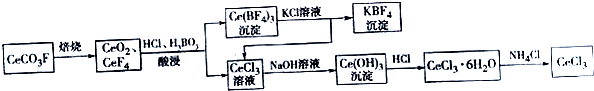
���� ���÷�̼�����Ҫ�ɷ�CeCO3F����ȡCeCl3��һ�ֹ�������Ϊ��CeCO3F���յ�CeO2��CeF4���������������������˵ó���Ce��BF��4��CeCl3��Һ��Ce��BF��4���Ȼ�����Һ��Ӧ�õ�CeCl3��KBF��CeCl3��ǰ����Һ��CeCl3�ĺϲ��ټ��������ƣ���Ce��OH��3������Ce��OH��3���������ᷴӦ�ɵ�CeCl3•6H2O������CeCl3•6H2O��NH4Cl�Ĺ�������ɵõ���ˮCeCl3��
��1�����ݻ��ϼ۴�����Ϊ0�жϣ�
��2��������������H2O2�ܻ�ԭCeO2����Ce3+������Ԫ���غ�͵���غ���д���ӷ���ʽ��
��3����Ce��BF4��3�м���KCl��Һ����CeCl3��KBF����ֹ����Ce��BF4��3������
��4����Һ�е�C��Ce3+������1��10-5mol•L-1������ΪCe3+������ȫ������KSP[Ce��OH��3]=C��Ce3+��•C3��OH-�� �ɼ������Һ�����������ӵ�Ũ�ȣ�����ȷ��PHֵ��
��5��NH4Cl�������ȷֽ����HCl����������CeCl3ˮ�⣬�ݴ˴��⣻
��6����0.1000mol•l-1��NH4��2Fe��SO4��2����Һ���25.00ml�������������ӵ����ʵ���Ϊ2.5��10-3mol�����ݷ�ӦFe2++Ce4+�TCe3++Fe3+������CeԪ���غ��֪���ɼ����CeCl3������������ȷ����Ʒ��CeCl3������������
����ʹ�þ��õģ�NH4��2Fe��SO4��2����Һ���еζ��������������ӱ��������������������Ի����ı�Һ�����Ϊƫ�ݴ˷�����
��� �⣺���÷�̼�����Ҫ�ɷ�CeCO3F����ȡCeCl3��һ�ֹ�������Ϊ��CeCO3F���յ�CeO2��CeF4���������������������˵ó���Ce��BF��4��CeCl3��Һ��Ce��BF��4���Ȼ�����Һ��Ӧ�õ�CeCl3��KBF��CeCl3��ǰ����Һ��CeCl3�ĺϲ��ټ��������ƣ���Ce��OH��3������Ce��OH��3���������ᷴӦ�ɵ�CeCl3•6H2O������CeCl3•6H2O��NH4Cl�Ĺ�������ɵõ���ˮCeCl3��
��1�����ݻ��ϼ۴�����Ϊ0��֪��CeCO3F�У�CeԪ�صĻ��ϼ�Ϊ+3�ۣ�
�ʴ�Ϊ��+3��
��2��ϡ���ᡢH2O2��CeO2��Ӧ�����ӷ���ʽΪ��H2O2+2CeO2+6H+=2Ce3++4H2O+O2����
�ʴ�Ϊ��H2O2+2CeO2+6H+=2Ce3++4H2O+O2����
��3����Ce��BF4��3�м���KCl��Һ����CeCl3��KBF����������Ŀ���DZ�����������Ce��BF4��3��������ʽ��ʧ���ȥBF4-�����CeCl3�IJ��ʣ�
�ʴ�Ϊ��������������Ce��BF4��3��������ʽ��ʧ���ȥBF4-�����CeCl3�IJ��ʣ�
��4����Һ�е�C��Ce3+������1��10-5mol•L-1������ΪCe3+������ȫ������KSP[Ce��OH��3]=C��Ce3+��•C3��OH-��=1��10-20��֪��C��OH-��=$\root{3}{\frac{1��1{0}^{-20}}{1��1{0}^{-5}}}$mol•L-1=1��10-5mol•L-1����ʱ��Һ��PHΪ9��
�ʴ�Ϊ��9��
��5������NH4Cl�������ȷֽ����HCl������CeCl3ˮ�⣬���Լ���CeCl3•6H2O��NH4Cl�Ĺ�������ɵõ���ˮCeCl3��
�ʴ�Ϊ��NH4Cl�������ȷֽ����HCl������CeCl3ˮ�⣻
��6����0.1000mol•l-1��NH4��2Fe��SO4��2����Һ���25.00ml�������������ӵ����ʵ���Ϊ2.5��10-3mol�����ݷ�ӦFe2++Ce4+�TCe3++Fe3+������CeԪ���غ��֪��CeCl3������Ϊ2.5��10-3mol��246.5g/mol=0.6163g��������Ʒ��CeCl3����������Ϊ$\frac{0.6163g}{0.7500g}$��100%=82.2%��
�ʴ�Ϊ��82.2%��
����ʹ�þ��õģ�NH4��2Fe��SO4��2����Һ���еζ��������������ӱ��������������������Ի����ı�Һ�����Ϊƫ�����ø�CeCl3��Ʒ����������ƫ��
�ʴ�Ϊ��ƫ��
���� ��������ȡCeCl3��һ�ֹ�������Ϊ���壬�����˻��ϼۡ����ӷ�Ӧ�������ܽ�ƽ��ļ��㡢ʵ�������������ѧ�����֪ʶ�����ط������ƶϼ�ʵ���������ۺϿ��飬��Ŀ�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ��Һ��һ������SO42-��NH4+��Cl- | |
| B�� | ԭ��Һ��һ��������Br-��Fe2+��SO32- | |
| C�� | ԭ��Һ�п��ܴ���SO32-��K+ | |
| D�� | ԭ��Һ�еζ�����K+��c��K+����0.2mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ռ�Cl2���ű���ʳ��ˮ�ķ��� | |
| B�� | �Ӵ�����ʹSO2��O2 ��һ��������ת��ΪSO3 | |
| C�� | ����Ũ��ˮ��NaOH��s��������ȡ���� | |
| D�� | ��ѹ������������N2��H2��Ӧ����NH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��1��ʵ��������ͼ��ʾװ���Ʊ���������������
��1��ʵ��������ͼ��ʾװ���Ʊ���������������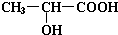 ���Իش�
���Իش�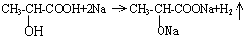 ��
��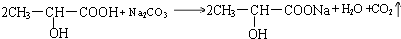 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�
������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�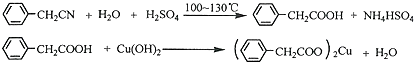
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
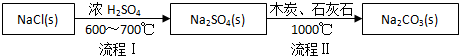
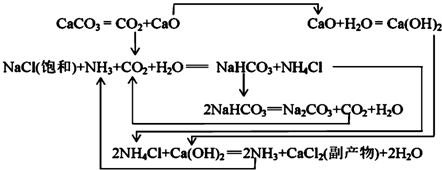
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
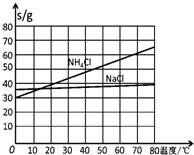
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

| ���� | �۵�/�� | �е�/�� | �ܽ��� |
| �������� | 114.3 | 305 | ������ˮ����������ˮ |
| ���� | -6 | 184.4 | ����ˮ |
| ���� | 16.6 | 118 | ������ˮ |
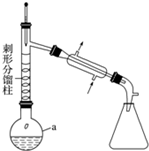
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
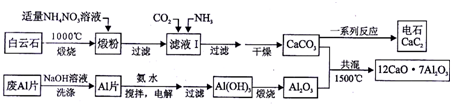
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 480mL����ƿ��7.68g����ͭ | B�� | 480mL����ƿ��12.0g���� | ||
| C�� | 500mL����ƿ��12.5g����ͭ | D�� | 500mL����ƿ��12.5g���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com