
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl.下列“水”电池在海水中放电时的有关说法正确的是( )
|
| A. | 正极反应式:Ag+Cl﹣﹣e﹣═AgCl |
|
| B. | 每生成2 molNa2Mn5O10转移1 mol电子 |
|
| C. | AgCl是还原产物 |
|
| D. | Na+不断向“水”电池的正极移动 |
考点:
化学电源新型电池.
分析:
根据电池反应式知,Ag失电子发生氧化反应而作负极,MnO2作正极,负极反应式为Ag+Cl﹣﹣e﹣═AgCl,正极反应式为5MnO2+2e﹣=Mn5O102﹣,电解质溶液中阳离子向正极移动,阴离子向负极移动,结合Na2Mn5O10和转移电子之间的关系式计算.
解答:
解:A.负极反应式为Ag+Cl﹣﹣e﹣═AgCl,正极反应式为5MnO2+2e﹣=Mn5O102﹣,故A错误;
B.根据5MnO2+2e﹣=Mn5O102﹣知,每生成2 molNa2Mn5O10转移4mol电子,故B错误;
C.Ag失电子作还原剂,则AgCl是氧化产物,故C错误;
D.电解质溶液中阳离子向正极移动,阴离子向负极移动,所以Na+不断向“水”电池的正极移动,故D正确;
故选D.
点评:
本题考查化学电源新型电池,会根据元素化合价变化确定正负极,难点是电极反应式的书写,为高考高频点.


科目:高中化学 来源: 题型:
实验室用碳酸钠晶体配制1.00mol•L﹣1的Na2CO3溶液100mL,造成所配溶液浓度偏低的原因是( )
A. 暴露在空气中称量碳酸钠晶体(Na2CO3•10H2O)的时间太长
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 洗涤液移入容量瓶中时,洒出一部分
查看答案和解析>>
科目:高中化学 来源: 题型:
将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
|
| A. | K+、SiO32﹣、Cl﹣、NO3﹣ | B. | H+、NH4+、Al3+、SO42﹣ |
|
| C. | Na+、S2﹣、OH﹣、SO42﹣ | D. | Na+、C6H5O﹣、CH3COO﹣、HCO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
|
| A. | 取a克混合物充分加热,得b克固体 |
|
| B. | 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
|
| C. | 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
|
| D. | 取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
室安卡因(G)是一种抗心率失常药物,可由下列路线合成
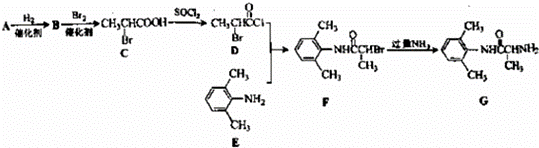
(1)已知A是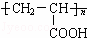 的单体,则A中含有的官能团是 (写名称).B的结构简式是 .
的单体,则A中含有的官能团是 (写名称).B的结构简式是 .
(2)C的名称(系统命名)是 ,C与足量NaOH醇溶液共热时反应的化学方程式是 .
(3)X是E的同分异构体,X分子中含有苯环,且苯环上一氯代物只有两种,则X所有可能的结构简式有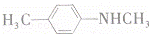 、 、 、 .
、 、 、 .
(4)F→G的反应类型是 .
(5)下列关于室安卡因(G)的说法正确的是 .
a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.能与盐酸反应生成盐 d.属于氨基酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是
A、氯气:K+、Ba2+、SiO32-、NO3- B.氨气:K+、Na+、AlO2-、CO32-
C.二氧化硫:Na+、NH4+、SO32-、C1- D.甲醛:Ca2+、Mg2+、MnO4-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
某可逆反应X(g)+Y(g)  Z(g)+2W(g),其化学平衡常数K和温度的关系如下表:
Z(g)+2W(g),其化学平衡常数K和温度的关系如下表:
| T/℃ | 700 | 800 | 850 | 1000 |
| K | 0.01 | 0.05 | 0.10 | 0.40 |
(1)上述反应的平衡常数表达式K=________,ΔH________0(填“>”或“<”)。加入催化剂,该反应的ΔH将________(填“增大”、“减小”或“不变”)。
(2)若上述反应在绝热恒容的密闭容器内进行,则能说明该反应达到化学平衡状态的依据有________。
A.混合气体的密度保持不变 B.v正(X)=v正(Z)
C.容器内温度恒定 D.W的质量分数不变
(3)在850 ℃、体积为1 L的密闭容器内,加入0.2 mol Z和0.3 mol W发生上述反应。X的c(X)-t曲线如图所示。
①0~4 min内W的平均速率为________mol·L-1·min-1。
②在5 min末将容器体积缩小至0.5 L,若在8 min末达到新平衡(此时X的浓度约为0.26 mol/L),请在图中画出5 min~9 min的X浓度的变化曲线。

查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。
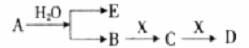
请回答下列问题:
(1)B中所含化学键的类型是______________。
(2)常温常压下,7.8g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式 。
(3)①C也可转化为B,写出该转化的化学方程式_______________。
②B与D反应的离子方程式为__________________________。
(4)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。
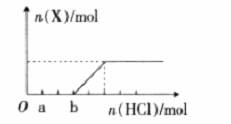
请回答:a 点溶液中所含溶质的化学式为__________,b 点溶液中各离子浓度由大到小的关系是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com