
分析 (1)根据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
(2))依据配制一定物质的量浓度溶液时的一般步骤解答;
(3)根据c=$\frac{n}{V}$进行误差分析,凡是引起n偏小或者V偏大的操作,所配溶液的浓度将会偏小;凡是引起n偏大或者V偏小的操作,所配溶液的浓度将会偏大.
解答 解:(1)浓H2SO4的物质的量浓度c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=100mL×1mol/L,解得:x≈5.4;
故答案为:5.4;
(2)配制一定物质的量浓度的溶液步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,所以正确的操作顺序为:②①③⑧⑤⑥⑦④;用到的仪器:量筒、玻璃棒、烧杯、胶头滴管、100mL容量瓶,所以还缺少的仪器:100mL容量瓶;
故答案为:②①③⑧⑤⑥⑦④,100mL容量瓶;
(3)①没有洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液浓度偏低;
②转移溶液时不慎有少量洒到容量瓶外面,导致溶质的物质的量偏小,溶液浓度偏低;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变;
④定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高;
⑤未冷却到室温就将溶液转移到容量瓶并定容,冷却后,液面下降,溶液体积偏小,溶液浓度偏高;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏高;
所以:操作会引起浓度偏高的是④⑤,无影响的是③;
故答案为:④⑤;③.
点评 本题考查学生化学实验的基本操作知识,熟悉配置一定物质的量浓度溶液的原理和操作步骤及常见仪器的使用方法是解题关键,注意容量瓶规格的选择及误差分析的方法和技巧.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:选择题
 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )| A. | 光照时,电流由Y流向X | |
| B. | 光照时,Pt电极发生的反应为2Cl-+2e-═Cl2 | |
| C. | 光照时,Cl-向Ag电极移动 | |
| D. | 光照时,电池总反应为:AgCl(s)+Cu+(aq)$\frac{\underline{\;光\;}}{\;}$Ag (s)+Cu2+(aq)+Cl-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
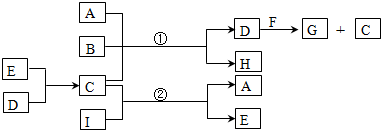
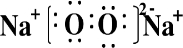 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 热稳定性:HF>HCl>HBr>HI | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸钠溶液与稀盐酸互滴时,两种操作现象不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
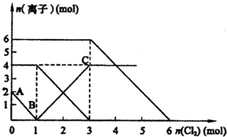 已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )| A. | 还原性:Fe2+>I->Br- | |
| B. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:2:3 | |
| C. | 原混合溶液中FeBr2的物质的量为6 mol | |
| D. | 当通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
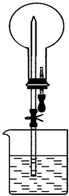 如图所示的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )
如图所示的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )| A. | SO2(饱和NaHSO3溶液) 无色喷泉 | B. | NH3(H2O含酚酞) 红色喷泉 | ||
| C. | H2S(CuSO4溶液) 黑色喷泉 | D. | HCl(AgNO3溶液) 白色喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 某溶液中滴加KSCN溶液呈无色,再滴加氯水后出现血红色,该溶液中含有Fe2+ | |
| B. | 某溶液中滴加NaOH溶液后再滴加CaCl2溶液出现白色沉淀,该溶液中含有CO32- | |
| C. | 某溶液中滴加氨水后再滴加NaOH溶液出现白色沉淀,该溶液中含有Al3+ | |
| D. | 某溶液中滴加足量稀盐酸后,再滴加BaCl2溶液才出现白色沉淀,该溶液中含有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com