
(6分)在①CH2=CH2 ② ③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
(1)属于高分子化合物的是 ;(请填物质的序号,下同。);
(2)能使Br2的CCl4溶液褪色的是 ;
(3)既能发生取代反应又能发生加成反应的是 ;
(4)能与Na2CO3溶液反应的是 ;
(5)能发生酯化反应的是 ;
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
对下图两种化合物的结构或性质描述正确的是
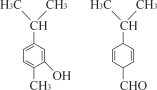
A.不是同分异构体
B.分子中共平面的碳原子数相同
C.均能与溴水反应
D.可用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高三10月月考化学试卷(解析版) 题型:填空题
(10分)已知铜在常温下能被HNO3溶解,反应方程式为:
3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
(1)请将上述反应改成离子方程式
___________________________________________________________________
(2)上述反应中,氧化剂是 _____________,氧化产物是_____________。
(3)每2 molCu参加反应,转移的电子__________ 个,在反应的硝酸中没有参加氧化还原反应的硝酸占总硝酸的________________。
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高三10月月考化学试卷(解析版) 题型:选择题
有关合金的叙述正确的是( )
A.合金的导电性比成分金属强
B.合金的抗腐蚀性能都很好
C.合金的机械强度比各成分金属小
D.多数合金比成分金属熔点低,硬度大
查看答案和解析>>
科目:高中化学 来源:2015届吉林省吉林市高三第一次摸底考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式,书写正确的是
A.将氯气通入水中:Cl2+H2O=2H++Cl—+ClO—
B.在铁粉中加入硫酸铁溶液:Fe3++Fe=2Fe2+
C.氧化铜溶于稀硝酸:CuO+2H+=Cu2++H2O
D.小苏打与氢氧化钠两种溶液混合:HCO3—+OH—=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源:2015届吉林省公主岭市高三上学期第二次月考化学试卷(解析版) 题型:选择题
取ag某物质在足量的氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了ag。下列物质中不能满足上述结果的是
A.H2 B.CO C.C12H22O11 D.C6H12O6
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:实验题
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol?L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol?L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol?L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol?L-1 FeCl3溶液中滴加2滴0.1 mol?L-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明 ;
实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 mol?L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH约为3。由此,乙认为红色不褪去的可能原因是 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
步骤 | 试剂及操作 | 现 象 |
i |
| 生成白色沉淀 |
ii | 向i所得溶液中滴加0.1 mol?L-1 FeCl3溶液 |
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com