
【题目】下列实验结论正确的是( )
A.向某溶液中加入酚酞,溶液不变色,则该溶液一定显酸性
B.向某溶液中加入氯化钡溶液产生白色沉淀,再加入盐酸沉淀不消失,则该溶液中一定有 ![]()
C.向某溶液中加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有 ![]()
D.向某溶液中滴加KSCN试剂,溶液变成血红色,则该溶液中一定有Fe3+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)。
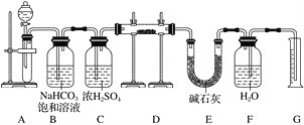
回答下列问题:
(1)装置A中液体试剂选用________________。
(2)装置B的作用是_________。装置E中碱石灰的作用是________。
(3)装置D中发生反应的化学方程式是__________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3,含SiO2和铁的氧化物等杂质)为原料制备铝与硫酸亚铁,工艺流程如图所示:请回答下列问题:
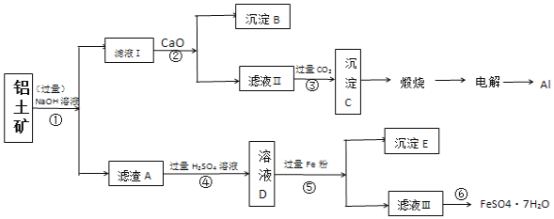
(1)步骤①中提高碱浸速率的方法_______。
(2)滤液Ⅰ中主要的阴离子是______。
(3)步骤⑤加入过量的铁粉的目的___(用离子方程式解释)
(4)检验滤液Ⅲ中的金属阳离子的方法是:_____。
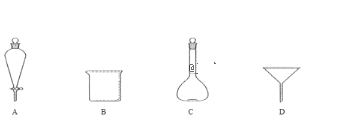
(5)滤液Ⅲ经过蒸发浓缩,_______,过滤得到硫酸亚铁晶体,过滤时需要的玻璃仪器有___(填标号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010 mol/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是
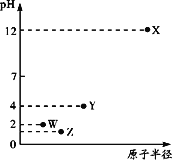
A. 简单离子半径:X>Y>Z>W
B. Y元素存在同素异形体
C. 气态氢化物的稳定性:Z>W>Y
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在好氧菌和厌氧菌作用下废液中NH4+能转化为N2(g)和H2O(l),示意图如下:
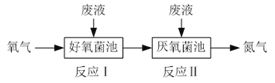
反应I:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH1=a kJ·mol-1
反应II:5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH2=b kJ·mol-1
下列说法正确的是
A. 两池发生的反应中氮元素只被氧化
B. 两池中投放的废液体积相等时NH4+能完全转化为N2
C. 常温常压下,反应II中生成22.4 L N2转移的电子数为3.75×6.02×1023
D. 4NH4+(aq)+3O2(g)=2N2(g)+4H+(aq)+6H2O(l) ΔH=![]() (3a+b) kJ·mol-1
(3a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl 2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1) 碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是________(填字母)。
a碳酸氢钠难溶于水
b 碳酸氢钠受热易分解
c 碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2) 某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
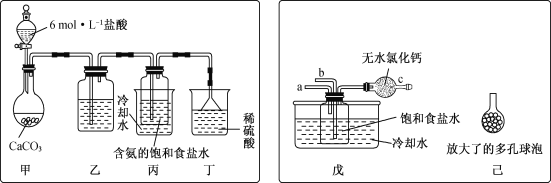
(Ⅰ)乙装置中的试剂是________________。
(Ⅱ)实验结束后,分离出NaHCO3晶体的操作是________(填名称)。
②另一位同学用图中戊装置(其他装置未画出)进行实验。
(Ⅰ)实验时,须先从________管通入________气体,再从________管通入________气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,可采用还原法处理尾气中NO,其原理:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
实验 | c(NO)/mol·L-1 | c(H2)/mol·L-1 | v(正)/mol·L-1·min-1 |
① | 0.10 | 0.10 | 0.414k |
② | 0.10 | 0.40 | 1.656k |
③ | 0.20 | 0.10 | 1.656k |
下列有关推断正确的是
A. 上述反应中,反应物的总能量低于生成物的总能量
B. 若升高温度,则k(正)增大,k(逆)减小
C. 在上述反应中,反应级数:m=2,n=1
D. 在一定温度下,NO、H2的浓度对正反应速率影响程度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com