
(11 分)(原创)能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
① | H2(g)+ | |||||||||
② | 2H2(g)+ O2(g)= 2H2O(l) △H =﹣572kJ/mol; | |||||||||
③ | C(s)+ | |||||||||
④ | C(s)+ O2(g)= CO2(g) △H =﹣393.5kJ/moL; | |||||||||
⑤ | CO2(g)+ 2H2O(g)= CH4(g)+ 2O2(g)△H = + 802kJ/moL | |||||||||
化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H | |||
键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 | |||
回答下列问题
(1)写出能表示H2燃烧热的热化学方程式 。
(2)已知C(s)+ H2O(g) H2(g)+ CO(g)△H = ___________ kJ/moL;
H2(g)+ CO(g)△H = ___________ kJ/moL;
(3)估算出C=O键能为 kJ/moL。
(4)CH4的燃烧热△H = — ___________ kJ/moL。
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为_________mol[保留到小数点后2位;已知:c (H2O)=4.2 J/(g·℃) ]。
(11分,除特殊注明外每空2分)
(1) (2)+ 131.5
(2)+ 131.5
(3)800 (4)890 (5)0.56(3分)
【解析】
试题分析:(1)25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热,根据2H2(g)+ O2(g)= 2H2O(l) △H =﹣572kJ?mol?1可得能表示H2燃烧热的热化学方程式为: 。
。
(2)根据盖斯定律,C(s)+ H2O(g) H2(g)+ CO(g)可由③—①所得,则?H=?H3—?H1=+ 131.5kJ?mol?1。
H2(g)+ CO(g)可由③—①所得,则?H=?H3—?H1=+ 131.5kJ?mol?1。
(3)设C=O键能为x,根据CO2(g)+ 2H2O(g)= CH4(g)+ 2O2(g)△H = + 802kJ/moL,可得关系式:2x+4×463—4×414—2×497=802,解得x=800。
(4)表示CH4燃烧热的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l),?H,根据盖斯定律,该反应等效于—①×2+②—⑤,带入各反应的焓变可得?H=—890kJ?mol?1。
(5)根据反应的热效应,n(CH4)×890000J?mol?1×90%×70%=1000g×(100℃—25℃)×4.2 J/(g·℃),解得n(CH4)=0.56mol。
考点:本题考查盖斯定律及热化学方程式、燃烧热、键能的计算、化学反应与能量的计算。


科目:高中化学 来源:2013-2014重庆市名校联盟高三三诊理综化学试卷(解析版) 题型:选择题
化学学习中,推理是一种重要的学习方法,下列推论正确的是
A.由“BF3和SO3互为等电子体”,可推知二者均为非极性分子
B.由“同主族元素性质相似,CO2为直线形分子”,可推知SiO2为直线形分子
C.由“SiH4的熔沸点比CH4高”,可推知PH3的熔沸点比NH3高
D.由“C、N、O三种元素的电负性C<N<O”,可推知第一电离能C<N<O
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:选择题
根据下列实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向等浓度且较稀的NaCl、KI混合 液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 向溶液x中滴加浓NaOH溶液, 将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
C | 溴乙烷与NaOH溶液共热后,加入 AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有发生水解
|
D | 将SO2通入溴水中 | 溴水褪色 | SO2具有还原性 |
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高二下学期期末考试化学试卷(解析版) 题型:实验题
(15分)某实验小组用下图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):
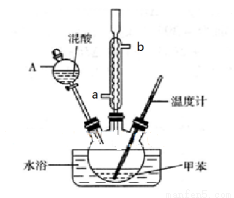
反应原理:
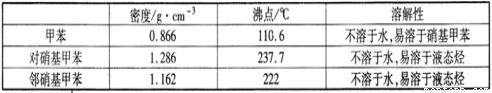
实验中可能用到的数据:
实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40 mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15 g。
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许________,目的是____________________。
(2)冷凝管的作用是_________;冷却水从冷凝管的_______(填“a”或“b”)端进入。
(3)仪器A的名称是________ ,使用该仪器前必须进行的操作是_________________。
(4)分离反应后产物的方案如下:

其中,操作1的名称为________,操作2必需的玻璃仪器有酒精灯、温度计、锥形瓶、牛角管(尾接管)和________________、_________________。
(5)本实验中一硝基甲苯的产率为________(结果保留小数点后一位数字)。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.N2的电子式: B.氯化钠的分子式:NaCl
B.氯化钠的分子式:NaCl
C.S2-的结构示意图: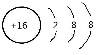 D. 乙烯的结构简式:C2H4
D. 乙烯的结构简式:C2H4
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
(原创)科学家发现海洋是一个名副其实的“聚宝盆”,一些国家觊觎我国南海海域的丰富资源,导致近年来南海争端不断。下列对海洋资源开发利用的说法不正确的是
A.海底如“土豆”般的金属结核矿含有铁、锰、钴等多种元素,可用铝热法冶炼并分离得到各种金属单质
B.海水淡化工厂可与化工生产结合,如淡化后的浓海水,可用于提溴、镁、钠等
C.海水中的金、铀等元素储量高、浓度低,提炼时,须先富集
D.海水提镁过程中,所需的石灰乳,可用贝壳煅烧后加水得到,体现了就地取材、降低成本的生产理念
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
(原创)短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中W的气态氢化物摩尔质量为34g/mol,Y的最低价氢化物为非电解质。则下列说法中正确的是
| X | Y |
|
Z |
| W | Q |
A.阴离子还原性:W > Q
B.X的最低价氢化物能形成分子间氢键
C.Q单质能溶于水,且水溶液须用棕色细口瓶盛装
D.Na与Y能形成化合物Na2Y2,且与水反应后溶液呈碱性
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
B. 0.l0mol·L-1的氨水加水稀释后,溶液中c(NH4+)、c(OH-)变大
C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变
D.若 LpH=11的NaOH溶液与
LpH=11的NaOH溶液与 LpH=3的HA溶液混合后显中性,则
LpH=3的HA溶液混合后显中性,则 ≤
≤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com