

分析 无色废水确定无Fe3+,根据实验①确定无Na+,根据实验②确定有SO42-,根据实验③确定有Al3+和Mg2+,故溶液中存在的离子为:Al3+、Mg2+、SO42-,根据硫酸钡沉淀求出n(SO42-),根据图象求出n(Al3+)和n(Mg2+),再根据电荷守恒确定有没有NO3-,以此解答该题.
解答 解:无色废水确定无Fe3+,根据实验①确定无Na+,根据实验②确定有SO42-,根据实验③确定有Al3+和Mg2+,故溶液中存在的离子为:Al3+、Mg2+、SO42-,根据硫酸钡沉淀求出n(SO42-),根据图象求出n(Al3+)和n(Mg2+),再根据电荷守恒确定有没有NO3-,
(1)焰色反应的操作步骤简记为洗、烧、蘸、烧、洗,洗铂丝的试剂是盐酸,为避免黄色光的干扰,滤去黄光,在观察K+的焰色时,必须要透过蓝色钴玻璃观察,
故答案为:盐酸;蓝色钴玻璃;
(2)配制1.0mol/L的NaOH溶液100mL,根据实验步骤所需仪器:玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管、100mL容量瓶、烧杯,
故答案为:100mL容量瓶;
(3)实验③中A→B过程是Al(OH)3与OH-发生反应,其方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)由以上分析可知溶液中存在的离子为:Al3+、Mg2+、SO42-,所以肯定存在的阳离子是Al3+、Mg2+,
故答案为:Al3+、Mg2+;
(5)液中存在的离子为:Al3+、SO42-、Mg2+,已知硫酸钡沉淀为2.33g,则n(SO42-)=$\frac{2.33g}{233g/mol}$=0.01mol,
根据图象可知与Al(OH)3的OH-为:n(OH-)=0.005mol,
Al(OH)3 +OH-=AlO2-+2H2O Mg2++2OH-=Fe(OH)2↓
n(Al3+) 0.005mol n(Mg2+) 0.035-3n(Al3+)
所以n(Al3+)=0.005mol,n(Mg2+)=0.01mol 所以溶液中Mg2+和Al3+所带正电荷与SO42-所带负电荷不相等,加入硝酸酸化,再滴入AgNO3溶液,未见白色沉淀生成,则一定不存在Cl-,因此存在NO3-,
故答案为:NO3-.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析、计算能力的考查,关键是图象分析离子特征和离子共存的判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
| t/min | 0 | 1 | 3 | 5 |
| N(H2)/mol | 8 | 6 | 5 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,VL水含有的氧原子个数约为V/22.4 NA | |
| B. | 常温常压下,1 mol 碳烯( CH2)所含的电子总数为8NA | |
| C. | 标准状况下,含NA个氩原子的氩气体积约为22.4L | |
| D. | 1mol OH-参与电解,提供的电子数目为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
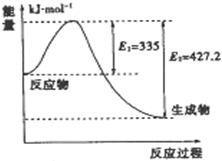 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用化学反应原理研究氮和硫的化合物有重要意义.
利用化学反应原理研究氮和硫的化合物有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
| Ⅰ(pH=2) | 0.4 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
| Ⅱ(pH=4) | 0.4 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
| Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
| Ⅳ(pH=4,含Ca2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
| A. | 在0~20 min内,Ⅰ中M的分解速率为0.015 mol•L-1•min-1 | |
| B. | 水样酸性越强,M的分解速率越快 | |
| C. | 在0~20 min内,Ⅲ中M的分解百分率比Ⅱ大 | |
| D. | 由于Ca2+存在,Ⅳ中M的分解速率比Ⅰ快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com