
| A.9.2g | B.10.6g | C.6.2g | D.4.6g |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
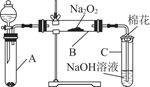
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入 ,再滴加 | , |
| 则证明生成物中含Na2SO4 | |
| 步骤3:往Ⅱ试管中 | |
| | 若 , |
| 则证明生成物中有Na2SO3;若 | |
| | |
| 则说明生成物中没有Na2SO3。 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
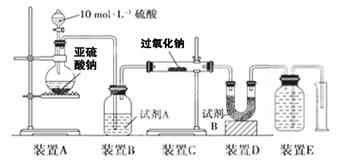
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.热稳定性:NaHCO3 > Na2CO3 |
| B.与澄清石灰水反应:Na2CO3、NaHCO3溶液中均有沉淀生成 |
| C.相同温度时,在水中的溶解性:NaHCO3 > Na2CO3 |
| D.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
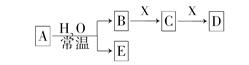
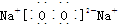
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等浓度时水溶液碱性:NaHCO3>Na2CO3 |
| B.热稳定性:NaHCO3>Na2CO3 |
| C.与盐酸溶液反应的速率(快慢):NaHCO3<Na2CO3 |
| D.向饱和 Na2CO3溶液中通入过量CO2,有晶体析出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
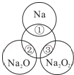
| A.Na2O2中阴阳离子数目之比为1:1 |
| B.反应①的离子方程式为:Na+2H2O=Na++2OH﹣+H2↑ |
| C.反应③最多能产生0.05mol O2 |
| D.①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com