
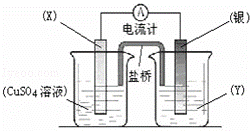
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极.
考点:
设计原电池.
专题:
电化学专题.
分析:
根据反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”分析,在反应中,Cu被氧化,失电子,应为原电池的负极,
电极反应为Cu﹣2e﹣=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,
电解质溶液为AgNO3 ,原电池中,电子从负极经外电路流向正极.
解答:
解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,
故答案为:正极; Ag++e﹣=Ag; Cu﹣2e﹣=Cu2+;
(3)原电池中,电子从负极经外电路流向正极,本题中由Cu极经外电路流向Ag极,故答案为:X(或Cu);Ag.
点评:
本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法性问题.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
一定条件下,CH3COONa溶液存在水解平衡:CH3COO﹣+H2O⇌CH3COOH+OH﹣.下列说法正确的是( )
|
| A. | 加入少量NaOH固体,c(CH3COO﹣) 减小 |
|
| B. | 升高温度,溶液的pH增大 |
|
| C. | 稀释溶液,溶液的pH增大 |
|
| D. | 通入少量HCl气体,水解平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作能达到目的是( )
|
| A. | 用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 |
|
| B. | 蒸干并灼烧AlCl3溶液可获得Al(OH)3固体 |
|
| C. | 用Na2S溶液和CuSO4溶液反应制取CuS固体 |
|
| D. | 蒸发MgCl2溶液制取MgCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁的锈蚀是工业上研究的重点内容.为研究铁锈蚀的影响因素,某同学用相同的铁丝在不同的气流中做了如下探究实验,记录如下:
| 序号 | 铁丝状态 | 温度℃ | 气流湿度 | 气流成分 | 时间 | 现象 |
| ① | 洁净光亮 | 25 | 干燥 | 空气 | 一个月 | 铁丝表面光亮 |
| ② | 洁净光亮 | 25 | 潮湿 | 空气 | 一天 | 铁丝表面光亮 |
| ③ | 洁净光亮 | 25 | 潮湿 | 空气 | 一个月 | 铁丝表面已经变暗 |
| ④ | 洁净光亮 | 25 | 潮湿 | 氧气 | 一天 | 铁丝表面略微变暗 |
| ⑤ | 洁净光亮 | 40 | 潮湿 | 氧气 | 一天 | A |
| ⑥ | 光亮铁丝表面有氯化钠溶液 | 25 | 潮湿 | 氧气 | 一天 | 铁丝表面变暗程度比④严重 |
回答以下问题:
(1)上述实验中发生了吸氧腐蚀的是 (填实验序号),正极反应式是 ﹣
(2)实验④⑥说明 是影响铁锈蚀的主要因素.如果实验④⑤是为说明温度对铁锈蚀速率的影响,则A处观察到的现象可能是 .
(3)为防止铁的锈蚀,地下埋的水管采用外接电源阴极保护法,则水管接电源的 极(填“正”或“负”)
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.1mol•L﹣1 NH3•H2O溶液中存在如下电离平衡:NH3•H2O⇌NH4++OH﹣.对于该平衡,下列叙述中正确的是( )
|
| A. | 降低温度,溶液中c(NH4+)增大 |
|
| B. | 加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 |
|
| C. | 加入少量0.1 mol•L﹣1 HCl溶液,溶液中c(OH﹣)增大 |
|
| D. | 加入水时,溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组通过测定大理石与硝酸反应过程中体系质量的变化,研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量均为25.0mL、大理石用量均为10.00g.
(1)请完成以下实验设计:
| 实验目的 | 实验编号 | T/K | 大理石规格 | c(HNO3) mol/L |
| (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响;) | ① | 298 | 粗颗粒 | 2.00 |
| ② | ||||
| ③ | ||||
| ④ |
(2)实验①中CO2质量随时间变化的关系见下图:
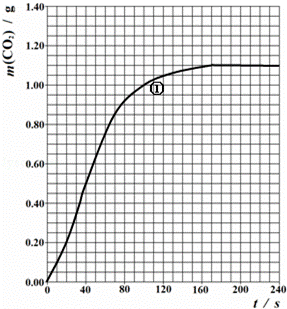
忽略溶液体积变化,计算实验①在40s﹣100s范围内HNO3的平均反应速率(保留2位小数): .
(3)请在答题纸上,画出实验②和③中CO2质量随时间变化关系的预期结果示意图.
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列说法正确的是( )
|
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA |
|
| B. | 28g乙烯所含共用电子对数目为4NA |
|
| C. | 1 mol甲基的电子数目为9NA |
|
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com