
用![]() 和硫粉在水溶液中进行热反应,可以制得
和硫粉在水溶液中进行热反应,可以制得![]() .10℃和70℃时,
.10℃和70℃时,![]() 在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是
在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是![]() ,俗称海波.
,俗称海波.![]() 在酸性溶液中立即完全分解:
在酸性溶液中立即完全分解:
![]()
现取15.1g![]() ,溶于80.0mL水.另取5.00g硫粉,用少量乙醇润湿后(以便硫粉被水浸润),加到上述溶液中.用小火加热至微沸,反应约1小时后过滤.滤液在100℃经蒸发、浓缩、冷却至10℃,析出
,溶于80.0mL水.另取5.00g硫粉,用少量乙醇润湿后(以便硫粉被水浸润),加到上述溶液中.用小火加热至微沸,反应约1小时后过滤.滤液在100℃经蒸发、浓缩、冷却至10℃,析出![]() 晶体.
晶体.
(1)若加入的硫粉不用乙醇润湿,对反应的影响是________.(填写选项字母)
[ ]
|
A.会降低反应速率 |
B.需要提高反应温度 |
|
C.将增大反应体系的pH值 |
D.会减少产量 |
(2)反应1小时后过滤.其目的是________.
(3)滤液中除![]() 和可能未反应完全的
和可能未反应完全的![]() 外,最可能存在的无机杂质是________.它是由________而产生的.如果滤液中该杂质的含量不很低,其检测的方法是________.
外,最可能存在的无机杂质是________.它是由________而产生的.如果滤液中该杂质的含量不很低,其检测的方法是________.
(4)设![]() 跟硫粉反应完全,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明.(70℃时
跟硫粉反应完全,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明.(70℃时![]() 饱和溶液的密度为1.17g/cm3)
饱和溶液的密度为1.17g/cm3)
(5)若要计算在100℃下将溶液蒸发至体积为300mL,再冷却至10℃时所能得到的![]() 的质量,你认为________(填写一个选项字母)
的质量,你认为________(填写一个选项字母)
[ ]
A.前面提供的数据已经足够.
B.还需要提供100℃时溶液的密度.
C.还需要提供结晶后剩余溶液的体积.
|
答案: (1)A、D (2)除去过量的硫粉. (3) (4)若反应得到
而23.8mL<30mL,所以蒸发后的溶液未饱和. 另法:若溶液已达饱和、设其中所含溶质
按题意,完全反应后实得的
因18.9g<24g,所以溶液未饱和. (5)B. 本题兼容性强,有选择、填空、计算、简答.内容主要是通过给出的新信息考查实验原理、操作、物质性质和相关计算. 题给的
从题述反应物只给出S和 计算 在已知 |
|
近年实验大题的兼容性强,往往不是单一的实验,不仅有物质性质等的考查,还可以有计算在内.题中的信息既有叙述,也有数据,藉此便于考查自学能力和观察与处理数据的能力. |


科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:022
硫代硫酸钠 俗称大苏打或海波,是无色或淡黄色结晶,能风化和潮解,纯品可作照相定影剂、去氯剂和分析试剂,还用于皮革、纺织等工业.
俗称大苏打或海波,是无色或淡黄色结晶,能风化和潮解,纯品可作照相定影剂、去氯剂和分析试剂,还用于皮革、纺织等工业.
(1)工业上制取硫代硫酸钠 ,用
,用 和硫粉在水溶液中加热反应而得到.但在混合前,一般先用少许乙醇浸润,其原因是什么?
和硫粉在水溶液中加热反应而得到.但在混合前,一般先用少许乙醇浸润,其原因是什么?
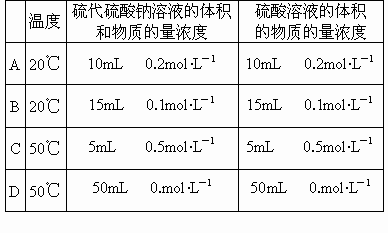
(2)又知: 通过析出硫的速率可以说明反应速率的快慢,请判断下列几种情况下,最先看到硫析出的是
通过析出硫的速率可以说明反应速率的快慢,请判断下列几种情况下,最先看到硫析出的是
[ ]

(3)对于上述反应,如果温度每升高10,反应速率增加为原来的3倍.那么20℃时看到沉淀开始析出的时间需54s,若将温度提高到50℃,看到沉淀开始析出的时间需______s.
查看答案和解析>>
科目:高中化学 来源:高一化学(通用各科奥林匹克ABC卷及解析) 题型:022
用![]() 和硫粉在水溶液中加热反应,可制得
和硫粉在水溶液中加热反应,可制得![]() .10℃和70℃时,
.10℃和70℃时,![]() 在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是
在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是![]() ·5
·5![]() .
.![]() 在酸性溶液中立即完全分解:
在酸性溶液中立即完全分解:
现取15.1g![]() ,溶于80.0mL水.另取5.00g硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中.用小火加热至微沸,反应约1小时后过滤.滤液在100℃经蒸发、浓缩,冷却至10℃后析出
,溶于80.0mL水.另取5.00g硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中.用小火加热至微沸,反应约1小时后过滤.滤液在100℃经蒸发、浓缩,冷却至10℃后析出![]() ·5
·5![]() 晶体.
晶体.
(1)若加入的硫粉不用乙醇润湿,对反应的影响是________.(填写选项的字母)
[ ]
(2)反应1小时后过滤,其目的是________.
(3)滤液中除![]() 和可能未反应完全的亚硫酸钠外,最可能存在的无机杂质是________.它是由________而产生的.如果滤液中该杂质的含量不很低,其检测的方法是:________.
和可能未反应完全的亚硫酸钠外,最可能存在的无机杂质是________.它是由________而产生的.如果滤液中该杂质的含量不很低,其检测的方法是:________.
(4)设![]() 跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明.(70℃时,
跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明.(70℃时,![]() 饱和溶液的密度为1.17
饱和溶液的密度为1.17![]() ).
).
(5)若要计算在100℃下将溶液蒸发至体积为30.0mL,再冷却至10℃时所能得到的![]() ·5
·5![]() 的质量,你认为________.(填写一个选项的字母)
的质量,你认为________.(填写一个选项的字母)
[ ]
A.前面提供的数据已经足够
B.还需要提供100℃时溶液的密度(1.14![]() )
)
C.还需要提供结晶后剩余溶液的体积(10.0mL)
(6)根据第(5)小题你的选择(如选(A)则直接计算,如选(B)或(C)则可选用其数据),计算从10℃,30.0mL溶液中结晶而出的![]() ·5
·5![]() 的质量.
的质量.
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
硫代硫酸钠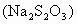 俗称大苏打或海波,是无色或淡黄色结晶,能风化和潮解,纯品可作照相定影剂、去氯剂和分析试剂,还用于皮革、纺织等工业.
俗称大苏打或海波,是无色或淡黄色结晶,能风化和潮解,纯品可作照相定影剂、去氯剂和分析试剂,还用于皮革、纺织等工业.
(1)工业上制取硫代硫酸钠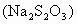 ,用
,用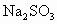 和硫粉在水溶液中加热反应而得到.但在混合前,一般先用少许乙醇浸润,其原因是什么?
和硫粉在水溶液中加热反应而得到.但在混合前,一般先用少许乙醇浸润,其原因是什么?
(2)又知: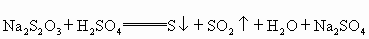 通过析出硫的速率可以说明反应速率的快慢,请判断下列几种情况下,最先看到硫析出的是
通过析出硫的速率可以说明反应速率的快慢,请判断下列几种情况下,最先看到硫析出的是
[ ]
(3)对于上述反应,如果温度每升高10,反应速率增加为原来的3倍.那么20℃时看到沉淀开始析出的时间需54s,若将温度提高到50℃,看到沉淀开始析出的时间需______s.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com