
| A、甲烷和乙烯 |
| B、甲烷和丙烯 |
| C、甲烷和丁烯 |
| D、乙烷和丙烯 |
| 8g |
| 16g/mol |
| 14.3g |
| 22g/mol |
| 6.3g |
| 0.15mol |


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
| A、元素Y形成的气态氢化物水溶液呈强酸性 |
| B、元素X与元素Y能形成离子化合物 |
| C、元素Z最高价氧化物对应水化物具有两性 |
| D、离子半径大小顺序均为:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
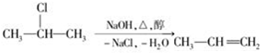

查看答案和解析>>
科目:高中化学 来源: 题型:
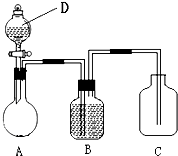 为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如图所示装置,一次实验即可达到目的(不必选用其他酸性物质).请据此实验回答下列问题:
为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如图所示装置,一次实验即可达到目的(不必选用其他酸性物质).请据此实验回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应①中a的值为5,b的值为8 |
| B、该滴定过程中选择的指示剂是酚酞 |
| C、样品中w(FeSO4?7H2O)=2.78V×100% |
| D、反应②是为了消除Fe3+的棕黄色对终点判断的干扰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
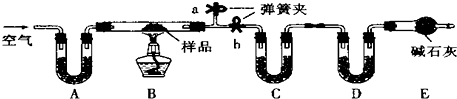
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、浓硫酸和铜粒 |
| B、浓氨水和氧化钙 |
| C、浓盐酸和浓硫酸 |
| D、水和电石 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com