
【题目】标准状况下,与28g N2的体积相等的O2,其
A.质量为16gB.分子数为6.02×1023
C.体积为11.2 LD.物质的量为2mol
科目:高中化学 来源: 题型:
【题目】自然界存在丰富的碳、氮、氧、铝、钾、铁、碘等元素,按要求回答下列问题:
(1)常温,羰基铁[Fe(CO)x)]是红棕色液体,不溶于水,溶于乙醇、乙醚等,据此判断羰基铁晶体属于________________(填晶体类型),羰基铁的配体是________。已知:羰基铁的中心原子价电子数与配体提供电子数之和为18,则x=_________;98g羰基铁中含有的![]() 键数为______________个。
键数为______________个。
(2)亚铁离子具有强还原性,从电子排布的角度解释,其原因是__________
(3)BN晶体、AlN晶体结构相似,如图1,两者熔沸点较高的物质是______,原因是_________

(4)KIO3晶体是一种性能良好的光学材料,其晶胞为立方体,晶胞中K、I、O分别处于顶点、体心、面心位置,如图2所示,如果KIO3密度为a g![]() cm-3,则K与O间的最短距离为___cm。
cm-3,则K与O间的最短距离为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漆酚![]() 是生漆的主要成分,黄色,能溶于有机溶剂。生漆涂在物体表面,能在空气中干燥转变为黑色漆膜,它不具有的化学性质为( )
是生漆的主要成分,黄色,能溶于有机溶剂。生漆涂在物体表面,能在空气中干燥转变为黑色漆膜,它不具有的化学性质为( )
A.可以燃烧,当氧气充分时,产物为CO2和H2O
B.与FeCl3溶液发生显色反应
C.能发生取代反应和加成反应
D.能与碳酸氢钠溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为______________________。
(2)A中的碳原子是否都处于同一平面?________(填“是”或“不是”)。
(3)A能发生如下转化,其中D1、D2互为同分异构体,E1、E2互为同分异构体。

反应②的化学方程式为_______________,C的化学名称是__________;E2的结构简式是______________,④、⑥的反应类型依次是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件可发生如下两个化学反应:
①Fe+H2SO4(稀)=FeSO4+H2↑ ②2Fe+6H2SO4(浓) = Fe2(SO4)3+3SO2↑+6H2O
试回答下列问题:
(1)反应①中_____元素被还原,氧化产物为__________;用单线桥表示该反应电子转移情况_________________;
(2)反应②中还原产物为__________,当反应②中生成32克SO2气体时,被还原的H2SO4有_______mol,用双线桥表示该反应电子转移情况____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15。不考虑溶液混合引起的体积变化和H2S的挥发,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.1mol·L-1NaHS溶液:c(Na+)>c(HS-)>c(H2S)>c(S2-)
B.0.1mol·L-1Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.0.2mol·L-1NaHS溶液和0.1mol·L-1NaOH溶液等体积混合:c(HS-)+3c(H2S)>c(S2-)
D.向0.1mol·L-1NaOH溶液中通入H2S至溶液呈中性:c(Na+)=c(HS-)+c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不能达到实验目的的是( )

A.用装置甲制备NH3
B.用装置乙除去SO2气体中的少量HCl
C.用湿润的红色石蕊试纸检验NH3
D.中和滴定时,滴定管用待装的试液润洗2~3次,减小实验误差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属氟化物一般都具有高容量、高质量密度的特点。氟离子热电池是新型电池中的一匹黑马,其结构如图所示。下列说法正确的是
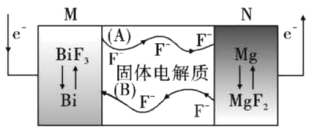
A. 图示中与电子流向对应的氟离子移动方向是(B)
B. 电池放电过程中,若转移1mol电子,则M电极质量减小12g
C. 电池充电过程中阳极的电极反应式为:B+3F--3e-=BiF3
D. 该电池需要在高温条件下工作,目的是将热能转化为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com