
在一定温度下,向一个2 L的真空密闭容器中事先装入催化剂,通入1 mol N2和3 mol H2,经过一段时间后,测得容器内压强为反应起始的0.9倍,在此时间内以H2表示的平均速率为0.1 mol·L-1·min-1,则所经过的时间是( )
A.5 min B.4 min C.3 min D.2 min
科目:高中化学 来源: 题型:
S2Cl2是一种重要的化工产品。常温时是一种有毒并有恶臭的金黄色液体,熔点-76℃,沸点138℃,易与水反应,进一步氯化可得SCl2,SCl2是樱桃红色液体,易挥发,熔点-122℃,沸点59℃。SCl2 与S2Cl2相似,有毒并有恶臭,但更不稳定。S2Cl2可用下列装置制备。
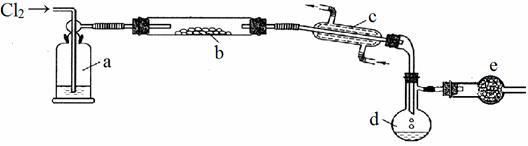
回答下列问题:
(1)写出S2Cl2的电子式_____________________;
(2)写出指定仪器的名称c___________________,d_________________________;
(3)a瓶盛放的试剂是_______________________ ;
(4)b中的反应开始前,需排除装置中的空气,应采取的方法是:_______________________;
(5)装置e中盛放的试剂是_____________其作用是①______________________________ ②___________________________________;
(6)得到纯净的S2Cl2,需要进行的操作是__________;
(7)若将S2Cl2放入水中同时产生沉淀和气体写出反应的方程式
___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)向硫酸铜溶液中滴加氨水溶液中先生成蓝色沉淀,然后蓝色沉淀消失,溶液变为深蓝色,加入乙醇后,溶液中析出深蓝色晶体,写出该深蓝色晶体的化学式 。
(2)乙醇的结构简式如图所示: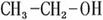 ,分子中C、O原子的杂化方式分别为-CH3 ,-CH2- ,-OH 。
,分子中C、O原子的杂化方式分别为-CH3 ,-CH2- ,-OH 。
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101KPa下,已知该反应每消耗1 mol CuCl(s),放出44.4KJ,该反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下有以下四种气体:①6.72 L CH4 ②3.01×1023个HCl分子 ③13.6 g H2S ④0.2 mol NH3。
(1)物质的量由小到大的顺序是____________。
(2)体积由小到大的顺序是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨的温度和压强通常控制在约500℃以及20 MPa~50 MPa的范围,当进入合成塔的N2和H2的体积比为1∶3时,经科学实验测定,在相应条件下N2和H2反应所得氨的平衡浓度(体积分数)如下表所示:

而实际上从合成塔出来的混合气体中含有氨约为15%。
请回答下列问题:
(1)298 K下合成氨时,每生成1 mol 氨气,同时放出46.2 kJ的热量,则该反应的热化学方程式为_________________________________________________。
氨气,同时放出46.2 kJ的热量,则该反应的热化学方程式为_________________________________________________。
在该温度下,取1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在的条件下进行反应,测得反应放出的热量总小于92.4 kJ,其原因是______________。
(2)实际上从合成塔出来的混合气体中氨的体积分数小于理论值的根本原因是_______________。
A.表中所测数据有明显误差
B.生产条件控制不当
C.氨的分解速率大于预测值
D.合成塔中的反应未达到平衡状态
(3)若工业生产中N2和H2按投料比1∶2.8的比例进入合成塔,那么转化率较大的应该是_________,采用此投料比的原因是______________,
若从合成塔出来的混合气体中氨的体积分数仍为15%,则N2和H2的转化率之比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,将1 mol/L的醋酸钠溶液用水稀释至0.1 mol/L,溶液中增大的是( )
A.c(OH-) B.c(CH3COOH) C. 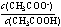 D. c(H+)
D. c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化氢(H2S)是一种无色剧毒有臭鸡蛋气味的气体,蛋白质腐败和某些生命活动中均可以产生硫化氢,在工农业生产及科研活动中有重要的用途。
资料:①H2S可溶于水,其水溶液叫氢硫酸,是一种二元弱酸。
②FeS是一种不溶于水的黑褐色块状固体,能溶于盐酸或稀硫酸生成H2S。
(1)某化学实验小组设计了制取少量H2S并验证其性质的实验,如下图所示。B中盛放CuSO4溶液,C中放有湿润的蓝色石蕊试纸,D中盛放FeCl3溶液。
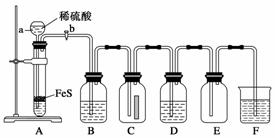
请回答下列问题:
①装置A中仪器a的名称是__________。写出装置A中发生反应的离子方程式____________;
②B中有黑色沉淀产生,B中发生反应的化学方程式为____________。工业上利用该反应检验Cu2+的存在,并使用H2S作为除去废水中某些重金属离子的沉淀剂;
③D中只有浅黄色沉淀产生,且溶液变浅绿色。写出发生反应的离子方程式______________。检验溶液中的Fe3+已经反应完全的操作过程______________。
(2)下图是实验室制取气体的常用反应装置。

现在该小组在实验室中要用硫化亚铁和稀硫酸制备较大量的H2S气体,可选择装置________。有同学选择了乙,请指出采用乙装置制取硫化氢气体的主要缺点________________。
(3)为进一步探究-2价硫的化合物与+4价硫的化合物发生反应的条件,该小组同学又设计了下列实验。
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
①根据上述实验,可以得出结论:在________条件下,+4价硫的化合物可以氧化-2价硫的化合物。
②已知:电离平衡常数:H2S Ka1=1.3×10-7;Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是________(填序号)。
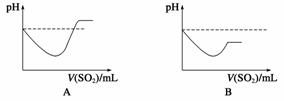

查看答案和解析>>
科目:高中化学 来源: 题型:
向10 mL 0.1 mol·L-1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液xmL,下列叙述正确的是( )
A.x=10时,溶液中有N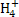 、Al
、Al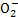 、S
、S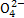 ,且c(N
,且c(N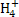 )>c(S
)>c(S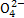 )
)
B.x=10时,溶液中有N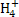 、Al3+、S
、Al3+、S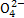 ,且c(N
,且c(N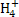 )>c(Al3+)
)>c(Al3+)
C.x=30时,溶液中有Ba2+、Al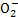 、OH-,且c(OH-)<c(Al
、OH-,且c(OH-)<c(Al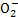 )
)
D.x=30时,溶液中有Ba2+、Al3+、Al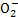 ,且c(OH-)=c(Ba2+)
,且c(OH-)=c(Ba2+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com