
下列说法不正确的是( )
|
| A. | 离子晶体的晶格能越大离子键越强 |
|
| B. | 阳离子的半径越大则可同时吸引的阴离子越多 |
|
| C. | 通常阴、阳离子的半径越小、电荷越大,该阴阳离子组成离子化合物的晶格能越大 |
|
| D. | 拆开1mol离子键所需的能量叫该离子晶体的晶格能 |
考点:
晶格能的应用.
专题:
化学键与晶体结构.
分析:
A、离子晶体的晶格能与离子键成正比;
B、阳离子半径越大,与阴离子接触面积越大,吸引阴离子越多;
C、离子晶体的晶格能与离子半径成反比,与电荷成正比;
D、晶格能的定义为气态离子形成1摩尔离子晶体释放的能量.
解答:
解:A、离子键与电荷成正比,与离子半径成反比,晶格能与电荷成正比,与离子半径成反比,所以离子晶体的晶格能越大离子键越强,故A正确;
B、阳离子半径越大,其表面积越大,与阴离子接触面积越大,吸引阴离子越多,故B正确;
C、离子晶体的晶格能与离子半径成反比,与电荷成正比,故C正确;
D、晶格能是气态离子形成1摩尔离子晶体释放的能量,不是拆开1mol离子键所需的能量,故D错误.
故选D.
点评:
本题考查了晶格能的有关知识,明确影响晶格能的因素是解本题的关键,难度不大.


科目:高中化学 来源: 题型:
运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:5KClO3+6P=3P2O5+5KCl.下列有关该反应的叙述中,正确的是()
A. 氯酸钾是还原剂
B. 反应中消耗3molP时,转移电子的物质的量为15mol
C. KCl既是氧化产物,又是还原产物
D. 发令时产生的白烟只是KCl固体颗粒
查看答案和解析>>
科目:高中化学 来源: 题型:
(现有X、Y、Z、W四种元素,前三种元素的离子结构都和氖原子具有相同的核外电子排布.X没有正价态的化合物;Y的氢化物为H2B;0.2mol的Z原子能从酸中置换出2.24LH2(标准状况);W的原子核内没有中子.
(1)X、Y、Z三种元素的名称依次为 , , .
(2)用电子式表示Z与X相互结合成化合物的过程: .
(3)写出Z与Y所形成的1:1型化合物跟W与Y所形成的化合物作用的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组元素中,第一电离能依次减小的是( )
|
| A. | H Li Na K | B. | Na Mg Al Si |
|
| C. | I Br Cl F | D. | F O N C |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如图,则下列判断错误的是( )
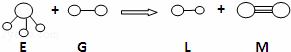
|
| A. | G是电负性最大的元素 |
|
| B. | 1个M分子中有2个σ键 |
|
| C. | E易液化是因为相对分子质量较大 |
|
| D. | L是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有硝酸银水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到无色的透明溶液.下列对此现象说法正确的是( )
|
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Ag+的浓度不变 |
|
| B. | 沉淀溶解后,生成的无色配合离子[Ag(NH3)2]+一定难电离 |
|
| C. | 向反应后的溶液中加入过量盐酸,无任何现象发生 |
|
| D. | 在[Ag(NH3)2]+离子中,既存在离子键,又存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种.若将纳米碳均匀地分散到蒸馏水中,所形成的物质()
①是溶液
②是胶体
③能产生丁达尔效应
④能透过滤纸
⑤不能透过滤纸
⑥静置后,会析出黑色沉淀.
A. ①④⑥ B. ②③⑤ C. ②③④ D. ①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是()
A. 胶体区别于其他分散系的本质特征是分散质的微粒直径在10﹣9﹣10﹣7m之间
B. 用平行光照射可以区分FeCl3溶液和Fe(OH)3胶体
C. 把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体
D. 肾衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com